题目内容
【题目】元素周期表的形式多种多样,下图是扇形元素周期表的一部分(前四周期的元素),对比中学常见元素周期表,回答下列问题:
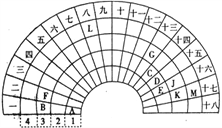
(1)E代表的元素处于常见周期表的位置是___________。G的离子结构示意图_____________。
(2)CE2的电子式是__________________。
(3)元素A和M形成的化合物的水溶液与元素K的单质反应的离子方程式为:__________________。反应后,向溶液中加入CK4溶剂,振荡后现象为____________________。
【答案】 第二周期第VIA族 
![]() Cl2+2Br=Br2+2Cl 溶液分层,下层溶液呈橙红色
Cl2+2Br=Br2+2Cl 溶液分层,下层溶液呈橙红色
【解析】本题考查元素周期表和元素周期律的结构,(1)根据E所在周期数和列数,E处于第二周期第VIA族,即为O;G位于第三周期第13列,即为Al,其离子是Al3+,离子结构示意图为 ;(2)C为C,E为O,即分子式为CO2,C和O共有2个电子对,即电子式为
;(2)C为C,E为O,即分子式为CO2,C和O共有2个电子对,即电子式为![]() ;(3)A为H,M为Br,两者形成的化合物是HBr,元素K为Cl,利用氯气的氧化性把Br2置换出来,即Cl2+2Br-=2Cl-+Br2;CK4是CCl4,溴单质易溶于有机溶剂,CCl4是密度大于水,且不溶于水的液体,因此现象是溶液出现分层,下层溶液呈橙红色。
;(3)A为H,M为Br,两者形成的化合物是HBr,元素K为Cl,利用氯气的氧化性把Br2置换出来,即Cl2+2Br-=2Cl-+Br2;CK4是CCl4,溴单质易溶于有机溶剂,CCl4是密度大于水,且不溶于水的液体,因此现象是溶液出现分层,下层溶液呈橙红色。

练习册系列答案
相关题目