题目内容
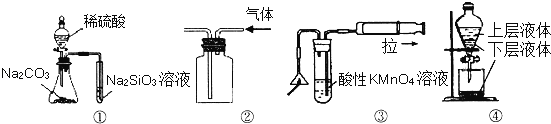
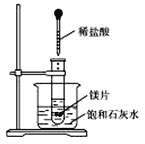
【题目】如图所示,把试管放入盛有25 ℃饱和石灰水的烧杯中,试管中开始放入几小块镁片,再滴入5 mL稀盐酸,试完成下列问题。
(1)实验中观察到的现象是__________________。
(2)产生上述现象的原因是__________________。
(3)写出有关反应的离子方程式__________________
(4)由实验推知,MgCl2溶液和H2的总能量_______________
(填“大于”“小于”或“等于”)镁片和盐酸的总能量。
(5)写出下列物质的电子式:Mg HCl NH4+ NaOH Na2O2
【答案】(1)镁片上有大量气泡产生;镁片逐渐溶解;烧杯中溶液变混浊
(2)镁与盐酸反应放热,Ca(OH)2的溶解度随温度升高而减小,故有固体析出
(3)Mg+2H+=Mg2++H2↑ Ca2++2OH-=Ca(OH)2 (4)小于
(5)![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]()
【解析】
试题分析:如图所示的实验中,向试管内滴入稀盐酸,盐酸与镁剧烈反应放出氢气,同时反应放出的热量使饱和石灰水溶液温度升高,温度升高氢氧化钙溶解度减小,饱和溶液析出固体氢氧化钙而使溶液看上去变浑浊。
(1)镁与盐酸剧烈反应,可观察到产生大量气体,反应放出热量使饱和溶液温度升高,析出固体溶质,观察到溶液变浑浊,所以实验中观察到的现象是镁片上有大量气泡产生;镁片逐渐溶解;烧杯中溶液变混浊;
(2)产生上述现象的原因是镁与盐酸反应放热,Ca(OH)2的溶解度随温度升高而减小,故有固体析出;
(3)镁与盐酸发生置换反应,生成氯化镁和氢气,反应的离子方程式为Mg+2H+=Mg2++H2↑,析出固体的离子方程式为Ca2++2OH-=Ca(OH)2;
(4)当反应物的总能量高于生成物的总能量时,反应是放热反应,所以MgCl2溶液和H2的总能量小于镁片和盐酸的总能量。
(5)镁的最外层有2个电子,电子式为![]() ;HCl是由共用电子对形成的共价化合物,电子式为
;HCl是由共用电子对形成的共价化合物,电子式为![]() ;NH4+中是由共价键形成带电原子团,电子式为
;NH4+中是由共价键形成带电原子团,电子式为![]() ;NaOH中含有离子键和共价键,电子式为
;NaOH中含有离子键和共价键,电子式为![]() ;Na2O2是Na+和O22-之间的离子键和O、O之间的共价键形成的离子化合物,电子式为
;Na2O2是Na+和O22-之间的离子键和O、O之间的共价键形成的离子化合物,电子式为![]() 。
。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】某同学进行下列实验:
操作 | 现象 |
取一块打磨过的生铁片,在其表面滴1滴含酚酞和K3[Fe(CN)6]的食盐水 |
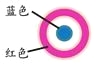
放置一段时间后,生铁片上出现如右图所示“斑痕”。其边缘处为红色,中心区域为蓝色,在两色环交界处出现铁锈 |
下列说法不合理的是
A. 生铁片发生吸氧腐蚀
B. 中心区:Fe–2e—==Fe2+
C. 边缘处:O2+2H2O+4e—==4OH—
D. 交界处:4Fe2++O2+10H2O==4Fe(OH)3+8H+