题目内容
12.亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3?H++H2PO3- 亚磷酸与足量NaOH溶液反应,生成Na2HPO3,写出亚磷酸与少量NaOH溶液反应的离子方程式H3PO3+OH-=H2PO3-+H2O.分析 根据题干信息:亚磷酸是二元酸存在电离平衡为弱酸,亚磷酸与足量NaOH溶液反应,生成Na2HPO3,说明亚磷酸分两步电离,亚磷酸和少量氢氧化钠反应生成NaH2PO3、H2O,据此书写离子方程式.
解答 解:亚磷酸是二元酸,亚磷酸与足量NaOH溶液反应,生成Na2HPO3,则亚磷酸的电离为:H3PO3?H++H2PO3-,H2PO3-?H++HPO32-,亚磷酸和少量氢氧化钠反应生成NaH2PO3、H2O,所以该反应方程式为:H3PO3+OH-=H2PO3-+H2O,
故答案为:H3PO3+OH-=H2PO3-+H2O.
点评 本题考查弱电解质的电离,根据题干信息判断亚磷酸的电离方程式是解答的关键,题目难度不大.

练习册系列答案
相关题目
2.工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个关键的步骤.其反应为:SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98kJ•mol-1.一定温度时,向容积为2L的恒容密闭容器中充入一定量的SO2和O2,一段时间后达到平衡,反应过程中测定的部分数据见表
(1)保持温度不变,向平衡后的容器中再充入1mol SO2和0.5mol O2,再次答平衡后,0.2mol/L<c(O2)<0.3mol/L
(2)保持其他条件不变,若起始时向容器中充入2mol SO3,达到平衡时吸收78.4kJ的热量.
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
(2)保持其他条件不变,若起始时向容器中充入2mol SO3,达到平衡时吸收78.4kJ的热量.
20.X、Y、M、N是短周期且原子序数依次增大的主族元素.已知X的最外层电子数是电子层数的3倍,X、M同主族,Y的原子在短周期主族元素中原子半径最大.下列有关说法正确的是( )
| A. | M、N的简单离子半径:r(N-)>r(M2-) | |
| B. | 气态氢化物的稳定性:M>X | |
| C. | X、Y形成的化合物中只有离子键 | |
| D. | X、Y、N所形成化合物的水溶液可能显中性或碱性 |
7.W、X、Y、Z均为短周期主族元素.Y的原子序数是W和Z的原子序数之和的一半,且其原子的最外层电子数与核外电子总数之比为2:7,W和Z形成的可溶性化合物WZ溶于水不能促进水的电离,W、X、Z三种元素形成的某种常见化合物M能消毒,下列说法正确的是( )
| A. | Y与Z形成的化合物中含 有离子键 | |
| B. | W、X、Z的简单离子中半径最大的是W | |
| C. | M的水溶液呈碱性 | |
| D. | 1molW单质与足量X单质反应,转移电子物质的量可能是2mol,也可能是1mol |
17.下列反应完成后没有沉淀的是( )
| A. | BaCl2溶液与Na2CO3溶液加足量稀盐酸 | |
| B. | Ba(OH)2溶液与KNO3溶液加足量稀H2SO4 | |
| C. | AgNO3溶液与Na2CO3溶液加足量稀HCl | |
| D. | Fe与足量CuSO4溶液反应后加足量稀H2SO4 |
4.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 加压有利于SO2与O2反应生成SO3 | |
| B. | 实验室中常用排饱和食盐水的方式收集氯气 | |
| C. | 打开汽水瓶,有气泡从溶液中冒出 | |
| D. | 500℃左右比常温下更有利于合成氨 |
1.设NA是阿伏加德罗常数的数值.下列说法正确的是( )
| A. | 分子数为NA的CO、N2混合气体的质量为28g | |
| B. | 0.1mol氧气作为氧化剂得到电子的数目一定为0.4NA | |
| C. | 22.4L氯气和氮气的混合气体含有2NA个原子 | |
| D. | 0.1mol•L-1的氢氧化钠溶液含有0.1NA个OH- |
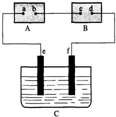 图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点显红色.试回答:
图中A为电源,B为浸透饱和食盐水和酚酞试液的滤纸,C为盛有稀硫酸的电解槽,e、f为铂电极.接通电路后,发现B上的c点显红色.试回答: