题目内容
为探究锌与稀盐酸反应速率[以v(H2)表示],向反应混合液中加入某些物质,下列判断正确的是
| A.加入铜粉,v(H2)增大 |
| B.加入NaHSO4固体,v(H2)不变 |
| C.加入水,锌不与水反应,v(H2)不变 |
| D.加入NaCl固体,会增大Cl-浓度,使v(H2)增大 |
A
解析试题分析:A、加入铜粉,形成锌铜原电池反应,加快了锌与稀盐酸反应速率,v(H2) 增大,故A正确;B、加入NaHSO4固体,氢离子的浓度增大,v(H2)增大,故B错误;C、加入少量水,浓度减小,则v(H2)减小,故C错误;D、锌与稀盐酸反应的实质是锌与氢离子反应,反应速率与Cl-浓度大小无关,故D错误,故选A。
考点:考查反应速率的影响因素

练习册系列答案
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案
相关题目
下列解释实际应用的原理表达式中,不正确的是
A.用排饱和食盐水法收集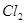 : :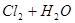  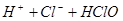 |
B.热的纯碱溶液碱性增强: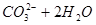  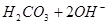 |
C.向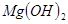 悬浊液中加入 悬浊液中加入 溶液: 溶液: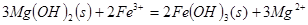 |
D.配制FeCl3溶液时为防止溶液浑浊常加入少量稀盐酸Fe3++3H2O Fe(OH)3+3H+, Fe(OH)3+3H+, |
在一定温度下的固定容积的密闭容器中,当下列物理量不再变化时,表明反应:
A(s)+2B(g) C(g)+D(g) 已达平衡的是
C(g)+D(g) 已达平衡的是
| A.混合气体的压强 | B.混合气体的密度 |
| C.生成l mol C的同时生成l mol D | D.气体的总物质的量 |
可逆反应A(g)+ 4B(g) C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
C(g)+ D(g),在四种不同情况下的反应速率如下,其中反应进行得最快的是( )
| A.vA==0.15mol/(L·min) | B.vB="=0.6" mol/(L·min) |
| C.vC="=0.4" mol/(L·min) | D.vD="=0.01" mol/(L·s) |
用铁片与稀硫酸反应时,下列措施不能使反应速率加快的是
| A.加热 | B.不用铁片,改用铁粉 |
| C.滴加少量的CuSO4溶液 | D.不用稀硫酸,改用98%浓硫酸 |
在四个不同的容器中,在不同条件下进行反应:N2+3H2 2NH3根据在相同时间内测定的结果判断,生成氨气的速率最快的是
2NH3根据在相同时间内测定的结果判断,生成氨气的速率最快的是
| A.υ(H2)=0.2mol·L-1·s-1 | B.υ(N2)=0.4mol·L-1·min-1 |
| C.υ(NH3)=0.3mol·L-1·s-1 | D.υ(H2)=0.6mol·L-1·min-1 |
一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g)  Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是
Y(g)+Z(g) △H<0,反应到8min时达到平衡;在14min时改变体系的温度, 16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是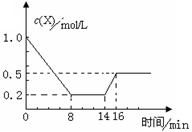
| A.0~8min用Y表示该反应速率为0.1mol·L-1·min-1 |
| B.8min时达到平衡,该反应的平衡常数为K= 0.5 |
| C.14min时,改变的反应条是降低了温度 |
| D.16min时的正反应速率比8min时的正反应速率大 |
 3C+5D反应中,表示该反应速率最快的是
3C+5D反应中,表示该反应速率最快的是 3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是