题目内容
【题目】化石燃料的燃烧会产生大量污染大气的二氧化硫和温室气体二氧化碳.而氢气和氨气都被认为是无碳无污染的清洁能源. 
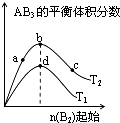
(1)某些合金可用于储存于氢,金属储氢的原理克表示为M+xH2═MH2x(M表示某种合金).如图1表示温度分别为T1、T2且T1<T2时最大吸氢量与氢气压强的关系.则该反应的△H0(填“>”或“<”)
(2)氨在氧气中燃烧,生成水和一种空气组成成分的单质.已知:N2(g)+3H2(g)2NH3(g)△H=﹣92KJmol﹣1及H2的燃烧热为286kJmol﹣1;试写出氨在氧气中燃烧生成液态水的热化学方程式: .
(3)在一定条件下,将1molN2和3molH2混合与一个10L的容积不变的密闭容器中发生反应,5分钟后达到平衡,平衡时氨的体积分数为25%.
①反应的平衡常数表达式为;
②反应开始到平衡时H2的消耗速率v(H2)=;
③能判断该反应是否达到化学平衡状态的依据是;
a 容器中压强不变 b.混合气体的密度不变
c.3v(H2)=2v(NH3) d.c(N2):c(H2):c(NH3)=1:3:2
④对于上述平衡状态,改变下列条件能使反应速率增大,且平衡向正向移动的是;
a 选用更高效的催化剂 b 升高温度c 及时分离出氨气 d 增加H2的浓度
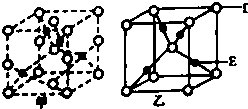
⑤如今采用SCY陶瓷固体电解质的电化学合成氨装置(如图2),该装置用可以传导质子的固态物质作为介质.电池总反应为N2(g)+3H2(g)2NH3(g),那么该电解池阴极反应式为 , 当阳极失去0.6mol电子时,阴极产生的气体在标准状态下的体积为 .
【答案】
(1)<
(2)4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=﹣1532kJ?mol﹣1
(3)K= ![]() ;0.024mol/(L﹒min);a;d;N2+6e﹣+6H+=2NH3;4.48L
;0.024mol/(L﹒min);a;d;N2+6e﹣+6H+=2NH3;4.48L
【解析】解:(1)在压强相同的条件下,T1对应的吸氢量大,又T1<T2 , 也就是T2→T1 , 降温平衡正向移动,所以正反应是放热反应,则△H<0;所以答案是:<;(2)N2(g)+3H2(g)2NH3(g)△H=﹣92kJmol﹣1 ①
由H2的燃烧热为286kJmol﹣1 , 则2H2(g)+O2(g)=2H2O(l)△H=﹣572kJmol﹣1 ②
根据盖斯定律,由②×3﹣①×2得:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=﹣572kJmol﹣1×3+92kJmol﹣1×2=﹣1532 kJmol﹣1
所以答案是:4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H=﹣1532 kJmol﹣1;(3)①该反应的平衡常数表达式K= ![]() ,所以答案是:K=
,所以答案是:K= ![]() ;
;
②设参加反应的氮气的物质的量xmol,
N2 + | 3H2 |
| 2NH3 | |
开始(mol): | 1 | 3 | 0 | |
变化(mol): | x | 3x | 2x | |
平衡(mol): | 1﹣x | 3﹣3x | 2x |
5min后达到平衡,平衡时氨的体积分数为 ![]() ×100%=25%,解:x=0.4,
×100%=25%,解:x=0.4,
H2的反应速率v(H2)= ![]() ×3=0.024mol/(L﹒min),所以答案是:0.024mol/(L﹒min);
×3=0.024mol/(L﹒min),所以答案是:0.024mol/(L﹒min);
③a.该可逆反应反应前后气体的物质的量发生变化,则容器内压强也不停变化,所以容器中压强不变,能说明反应到达平衡,故a正确;
b.因为反应前后总质量不变,又体积不变,所以混合气体的密度始终不变,则混合气体的密度不变,不能说明反应到达平衡,故b错误;
c.3v(H2)=2v(NH3),未指明正逆方向,不能说明反应到达平衡,故c错误;
d.c(N2):c(H2):c(NH3)=1:3:2时可能处于平衡状态,可能不处于平衡状态,与反应的条件有关,故d错误;
故选:a;
④a.选用更高效的催化剂,能增大正反应速率,但平衡不移动,故a错误;
b.升高温度,能增大正反应速率,但平衡向吸热的逆向移动,故b错误;
c.及时分离出氨气,反应速率减慢,故c错误;
d.增加H2的浓度,增大反应物的浓度,能增大正反应速率,平衡正向移动,故d正确;
故选d;
⑤阴极发生还原反应,氮气在阴极上放电,与氢离子结合生成氨气,电极反应式为N2+6e﹣+6H+=2NH3 , 当阳极失去0.6mol电子时,则阴极得到0.6mol电子,所以产生的气体在标准状态下的体积为 ![]() ×2×22.4L/mol=4.48L,所以答案是:N2+6e﹣+6H+=2NH3;4.48L.
×2×22.4L/mol=4.48L,所以答案是:N2+6e﹣+6H+=2NH3;4.48L.
【考点精析】解答此题的关键在于理解反应热和焓变的相关知识,掌握在化学反应中放出或吸收的热量,通常叫反应热,以及对化学平衡状态的判断的理解,了解状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等.

【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素,它们的单质及其化合物之间有很多转化关系,如表所列物质不能按如图关系(“→”表示一步完成)相互转化的是( )
选项 | A | B | C | D |
a | Na | Al | Fe | Cu |
b | NaOH | Al2O3 | FeCl3 | CuSO4 |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |

A.A
B.B
C.C
D.D