题目内容
【题目】A、B、C、D、E五种元素的元素序数依次增大.A的原子序数等于周期数;B的最外层电子数是次外层电子数的2倍,D的L层有两对成对电子;E+的核外有三个电子层,且都处于全满状态.试回答下列问题:
(1)基态E原子核外电子的排布式为
(2)A、C、D三种元素形成的常见离子化合物中阳离子的空间构型为 , 阴离子的中心原子轨道采用杂化.
(3)B、C、D三种元素的第一电离能有大到小的顺序是(填元素符号)
(4)E(CA3)42+离子的颜色是;含有化学键类型是;该配离子中心离子的配位数为
(5)D、E能形成两种晶体,其晶胞分别如甲、乙两图.在一定条件下,甲和C2A4反应生成乙,同时生成在常温下分别为气体和液体的另外两种常见无污染物质.该化学反应方程式为 . 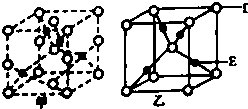
【答案】
(1)1s22s22p63s23p63d104s1
(2)正四面体;sp2
(3)N>O>C
(4)深蓝色;共价键、配位键;4
(5)4CuO+N2H4 ![]() 2Cu2O+2H2O+N2↑
2Cu2O+2H2O+N2↑
【解析】解:(1)A、B、C、D、E五种元素的原子序数依次增大,A的原子序数等于周期数,则A是H元素;B的最外层电子数是次外层电子数2倍,则B是C元素;D的L层有两对成对电子,其L层的电子排布式为:2s22p4 , 所以D为O元素;C的原子序数介于C、O之间,所以C为N元素;E+的核外有三个电子层,且都处于全满状态,则E+的电子排布式为1s22s22p63s23p63d10 , 其原子的电子排布式为:1s22s22p63s23p63d104s1 , 其原子序数为29,则为Cu元素,(1)基态Cu原子核外电子的排布式为1s22s22p63s23p63d104s1;
所以答案是:1s22s22p63s23p63d104s1;(2)NH4+ 的中心原子氮原子价层电子对数= ![]() =4,孤电子对=
=4,孤电子对= ![]() =0,所以NH4+ 的空间构型为正四面体,NO3﹣的中心原子氮原子价层电子对数=
=0,所以NH4+ 的空间构型为正四面体,NO3﹣的中心原子氮原子价层电子对数= ![]() =3,所以氮原子按sp2方式杂化,
=3,所以氮原子按sp2方式杂化,
所以答案是:正四面体;sp2;(3)同周期自左而右第一电离能增大,但N原子最外层为半充满结构,第一电离能大于O,应为N>O>C,
所以答案是:N>O>C;(4)铜离子与氨气结合生成Cu(NH3)42+离子,铜氨络离子显深蓝色,Cu(NH3)42+中铜离子与氨气之间形成4个配位键,N与H形成共价键;
所以答案是:深蓝色;共价键、配位键;4;(5)O、Cu形成的化合物,晶胞甲中,白色球数目=1+8× ![]() +2×
+2× ![]() +4×
+4× ![]() =4,黑色球数目为4,故该晶体中Cu、O原子数目之比为1:1,该化合物为CuO;晶胞乙中白色球数目=1+8×
=4,黑色球数目为4,故该晶体中Cu、O原子数目之比为1:1,该化合物为CuO;晶胞乙中白色球数目=1+8× ![]() =2,黑色球数目为4,为A2B型,故该化合物化学式为Cu2O;在一定条件下,CuO和N2H4反应生成Cu2O,同时生成在常温下分别为气体和液体的另外两种常见无污染物质,由元素守恒可知,生成氮气和水,则反应方程式为:4CuO+N2H4
=2,黑色球数目为4,为A2B型,故该化合物化学式为Cu2O;在一定条件下,CuO和N2H4反应生成Cu2O,同时生成在常温下分别为气体和液体的另外两种常见无污染物质,由元素守恒可知,生成氮气和水,则反应方程式为:4CuO+N2H4 ![]() 2Cu2O+2H2O+N2↑,
2Cu2O+2H2O+N2↑,
所以答案是:4CuO+N2H4 ![]() 2Cu2O+2H2O+N2↑.
2Cu2O+2H2O+N2↑.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案