题目内容
【题目】下列叙述正确的是![]()
A.地下钢铁管道用导线连接铜块可以减缓管道的腐蚀
B.反应![]() 的熵变
的熵变![]()
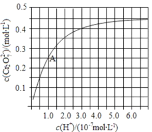
C.常温下,![]() ,
,![]() 的含
的含![]() 溶液中,
溶液中,![]()
D.![]() 时,
时,![]() 的
的![]() 溶液与等浓度的
溶液与等浓度的![]() 溶液的导电能力相同
溶液的导电能力相同
【答案】C
【解析】
A. 地下钢铁管道用导线连接着铜块,在潮湿环境中构成原电池,金属铁较活泼,是负极,易被腐蚀,故A错误;
B. 该反应气体分子数减少,属于熵减小的反应,故B错误;
C. pH=10,则氢氧根离子浓度为1×10-4 mol/L,含Mg2+溶液中存在: c (Mg2+)×c2(OH-)= c (Mg2+)×(1×10-4)2≤Ksp[Mg(OH)2]=5.6×10-12,即c (Mg2+)≤5.6×10-4,故C正确;
D. H2S是弱电解质,不能完全电离,Na2S是强电解质,可以完全电解,同浓度溶液中,Na2S溶液中的离子浓度更大,所以导电能力更强,故D错误;
答案选C。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
【题目】下列实验的操作、现象和结论(或解释)均正确的是( )
操作 | 现象 | 结论(或解释) | |
A | 向某溶液中滴加Ba(NO3)2溶液和稀盐酸 | 生成白色沉淀 | 原溶液中有SO42- |
B | 密闭容器中有反应:A(g)+B(g) | 再次达到平衡时测得c(C)为0.8mol·L-1 | x=l,增大压强平衡正向移动 |
C | 往试管中加入2mL 10%的CuSO4溶液,再滴入4~6滴2%的NaOH溶液,振荡后加入2mL葡萄糖溶液,加热煮沸 | 产生砖红色沉淀 | 葡萄糖分子结构中有醛基 |
D | 向某溶液中滴加新制氯水和CCl4,振荡、静置 | 下层溶液显紫红色 | 原溶液中有I- |
A.AB.BC.CD.D