题目内容
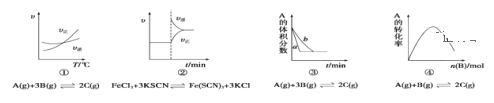
【题目】在一定温度下的定容容器中,当下列物理量不再发生变化时,不能表明可逆反应: A(s)+2B(g)![]() C(g)+D(g) +Q已达到平衡状态的是( )
C(g)+D(g) +Q已达到平衡状态的是( )
A.混合气体的密度B.混合气体的压强
C.混合气体的平均摩尔质量D.反应放出的热量
【答案】B
【解析】
可逆反应A(s)+2B(g)![]() C(g)+D(g)达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,注意该反应中A为固态,且反应前后气体物质的量不变,据此解答。
C(g)+D(g)达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,注意该反应中A为固态,且反应前后气体物质的量不变,据此解答。
A. 该容器的体积保持不变,根据质量守恒定律知,反应前后混合气体的质量会发生变化,所以容器内气体的密度是变化的量,当容器中气体的密度不再发生变化时,能表明反应达到化学平衡状态,A项不选;
B. 该反应是反应前后气体物质的量不变的反应,容器中的压强始终不发生变化,所以混合气体的压强不变,不能证明反应达到了平衡状态,B项选
C. 该反应前后气体的总物质的量不变,而气体的质量发生变化,则气体的平均摩尔质量是变化的量,当混合气体的平均摩尔质量不变时,能表明反应达到化学平衡状态,C项不选;
D. 该反应为放热反应,随着反应的进行,不断放出热量,当反应放出的热量不变时,能表明反应达到化学平衡状态,D项不选;
答案选B。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目