题目内容
【题目】镍及其化合物用途广泛。某矿渣的土要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,如图是从该矿渣中回收NiSO4的工艺路线:
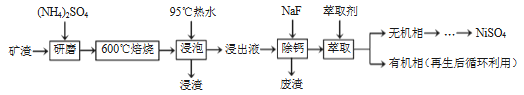
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4,NiFe2O4在焙烧过程中
生成NiSO4、Fe2(SO4)3。锡(Sn)位子第五周期第IVA族.
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是________________。
(2)"浸泡“过程中Fe2(SO4)3生成FeO(OH)的离子方程式为__________,“浸渣”的成分除Fe2O3、FeO(OH)外还含有____________ (填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将 Fe3+还原为Fe2+ ,所需SnCl2的物质的量不少于Fe3+物质的量的_____倍;除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+ ,还原产物为Cr3+,滴定时反应的离子方程式________________。
⑷“浸出液”中c(Ca2+) =1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-)=______mol·L-1。[己知Ksp(CaF2) > 4.0×10-11]
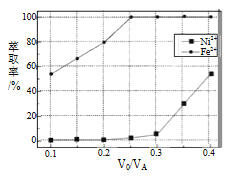
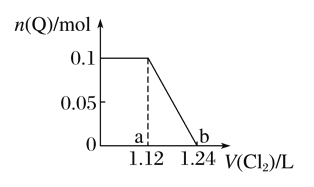
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,V0/VA的最佳取值是__________。
(6)己知正十二烷可用作该工艺的萃取剂。用电化学制备正十二烷的方法为:向烧杯中加入50mL甲醇,不断搅拌加入少量金属钠,再加入11mL正庚酸搅拌均匀,装好铂电极,接通电源反应,当电流明显减小时切断电源,然后提纯正十二烷。己知电解总反应为:
2C6H13COONa + 2CH3OH![]() C12H26 + 2CO2↑+H2↑+2CH3ONa
C12H26 + 2CO2↑+H2↑+2CH3ONa
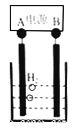
下列说法正确的是(_____)
A.图中电源的A极为直流电源的负极
B.加入金属钠可以将酸转化为钠盐,提高离子浓度,增强导电性
C.阳极电极反应为:2C6H13COO--2e- =C12H26+2CO2↑
D.反应一段时间后将电源正负极反接,会产生杂质影响正十二烷的制备
【答案】 增大接触面积,加快反应速率,使反应更充分 Fe3++2H2O![]() FeO(OH)↓+3H+ SiO2、CaSO4 0.5 Cr2O72- +6Fe2++14H+ =2Cr3++6Fe3++7H2O c (F+ ) =2.0×10-3 mol·L-1 0.25 D
FeO(OH)↓+3H+ SiO2、CaSO4 0.5 Cr2O72- +6Fe2++14H+ =2Cr3++6Fe3++7H2O c (F+ ) =2.0×10-3 mol·L-1 0.25 D
【解析】(1)焙烧前将矿渣与(NH4)2SO4混合研磨,以增大接触面积,加快反应速率,使反应更充分;(2)放在95℃热水中浸泡,使Fe3+发生水解,即离子反应方程式为:Fe3++2H2O![]() FeO(OH)↓+3H+,SiO2不溶于水,Ca2+和SO42-生成微溶于水的CaSO4,因此浸渣中除Fe2O3、FeO(OH)外,还有SiO2和CaSO4;(3)根据得失电子数目守恒n(Sn2+)×2=n(Fe3+)×1,解得n(Sn2+):n(Fe3+)=0.5,K2Cr2O7→Cr3+,化合价除低3价,共降低6价,Fe2+→Fe3+,化合价升高1价,最小公倍数6,因此离子反应方程式为:Cr2O72- +6Fe2++14H+ =2Cr3++6Fe3++7H2O;(4)除钙后溶液中c(Ca2+) =1%×1.0×10-3mol·L-1=1.0×10-5mol·L-1,由Ksp(CaF2)= c(Ca2+)×c2(F-),得c(F-)=2.0×10-3mol·L-1;(5)要求Fe2+萃取率最低,Ni2+的萃取率最高,根据图像,最佳取值为0.25;(6)A、A连接的电极生成氢气,发生还原反应,则A为负极,选项A正确;B、C6H13COONa为强电解质,导电能力比正庚酸强,选项B正确;C、阳极发生氧化反应,电极方程式为2C6H13COO--2e-=C12H26+2CO2↑,选项C正确;D、因C12H26为液体,而杂质为气体,不影响C12H26的制备,选项D错误。答案选D。
FeO(OH)↓+3H+,SiO2不溶于水,Ca2+和SO42-生成微溶于水的CaSO4,因此浸渣中除Fe2O3、FeO(OH)外,还有SiO2和CaSO4;(3)根据得失电子数目守恒n(Sn2+)×2=n(Fe3+)×1,解得n(Sn2+):n(Fe3+)=0.5,K2Cr2O7→Cr3+,化合价除低3价,共降低6价,Fe2+→Fe3+,化合价升高1价,最小公倍数6,因此离子反应方程式为:Cr2O72- +6Fe2++14H+ =2Cr3++6Fe3++7H2O;(4)除钙后溶液中c(Ca2+) =1%×1.0×10-3mol·L-1=1.0×10-5mol·L-1,由Ksp(CaF2)= c(Ca2+)×c2(F-),得c(F-)=2.0×10-3mol·L-1;(5)要求Fe2+萃取率最低,Ni2+的萃取率最高,根据图像,最佳取值为0.25;(6)A、A连接的电极生成氢气,发生还原反应,则A为负极,选项A正确;B、C6H13COONa为强电解质,导电能力比正庚酸强,选项B正确;C、阳极发生氧化反应,电极方程式为2C6H13COO--2e-=C12H26+2CO2↑,选项C正确;D、因C12H26为液体,而杂质为气体,不影响C12H26的制备,选项D错误。答案选D。