题目内容
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
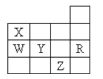
A.常压下五种元素的单质中Z单质的沸点最高
B.Y、Z的阴离子电子层结构都与R原子的相同
C.W的氢化物的稳定性比X的氢化物的稳定性强
D.Y元素的非金属性比W元素的非金属性强
【答案】D
【解析】
图为元素周期表前四周期的一部分,由元素的位置可知,X为N元素,W为P元素,Y为S元素,R为Ar元素,Z为Br元素,结合元素周期律分析解答。
A.常温下Y的单质为固体,而Z的单质为液体,则常压下五种元素的单质中一定不是Z单质的沸点最高,故A错误;
B.Y的阴离子电子层结构与R原子的相同,而Z的阴离子电子层结构与R原子的不相同,故B错误;
C.非金属性X>W,非金属性越强,气态氢化物越稳定,则W的氢化物的稳定性比X的氢化物的稳定性弱,故C错误;
D.同一周期从左向右,非金属性增强,对应氢化物的稳定性增强,则Y元素的非金属性比W元素的非金属性强,故D正确;
故选D。

 名师点拨卷系列答案
名师点拨卷系列答案【题目】某实验小组为了探究铝与盐酸反应过程中的速率变化,分两组做了以下实验。
(1)甲小组同学用足量的铝与50 mL盐酸发生反应,并用排水集气法收集反应放出的氢气,实验记录如下:
时间/min | 1 | 2 | 3 | 4 | 5 | 反应结束时 |
氢气体积/mL(标准状况下) | 50 | 150 | 300 | 380 | 410 | 560 |
①哪一时间段(即0~1、1~2、2~3、3~4、4~5 min)反应速率最大__,原因是____;
②反应进行到10 min时,便不再有气泡产生,该盐酸中HCl的物质的量浓度是__,整个反应过程中HCl的反应速率为____;
(2)乙小组学生也做了同样的实验,但由于反应太快,不好测量氢气体积,他事先在盐酸中加入等体积的下列液体:A.蒸馏水、B.KCl溶液、C.KNO3溶液、D.CuSO4溶液,以减慢反应速率,你认为可行的是____,不可行的理由是_________。
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2 L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 当容器中气体的密度不变时,该反应达到平衡状态
B. 该反应进行到第3分钟时,逆反应速率小于正反应速率
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01 mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4