题目内容
1.下列各组物质的溶液混合,如果其中酸过量时,仍有沉淀生成的是( )| A. | NaOH、FeCl3、H2SO4 | B. | HCl、K2CO3、BaCl2 | ||
| C. | CuSO4、HCl、KOH | D. | BaCl2、HNO3、AgNO3 |
分析 离子之间结合生成沉淀,或沉淀不溶于酸,符合题意,以此来解答.
解答 解:A.NaOH、FeCl3可反应生成沉淀,沉淀可溶于酸,酸过量时不生成沉淀,故A不选;
B.K2CO3、BaCl2可反应生成沉淀,沉淀可溶于盐酸,则酸过量时不生成沉淀,故B不选;
C.CuSO4、KOH可反应生成沉淀,沉淀可溶于盐酸,则酸过量时不生成沉淀,故C不选;
D.BaCl2、AgNO3反应生成的AgCl沉淀不溶于HNO3,则硝酸过量生成仍有沉淀,故D选;
故选D.
点评 本题考查离子的共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重复分解反应的离子共存考查,题目难度不大.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
15.下列说法正确的是( )
①最外层电子数是2的元素一定是金属元素
②元素周期表中,非金属性最强的元素是F
③盐酸是强酸,H2S是弱酸,故非金属性:Cl>S
④X元素的阳离子和Y元素的阴离子具有相同的电子层结构,则原子序数:X>Y
⑤O2和O3属于同素异形体,故它们的性质相同.
①最外层电子数是2的元素一定是金属元素
②元素周期表中,非金属性最强的元素是F
③盐酸是强酸,H2S是弱酸,故非金属性:Cl>S
④X元素的阳离子和Y元素的阴离子具有相同的电子层结构,则原子序数:X>Y
⑤O2和O3属于同素异形体,故它们的性质相同.
| A. | ①④ | B. | ①③⑤ | C. | ①②④ | D. | ②④ |
9.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
合成反应:在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为 .
.
(4)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶
D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50%C.61% D.70%

可能用到的有关数据如下:
| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
分离提纯:反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是直形冷凝器.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为
 .
.(4)分液漏斗在使用前须清洗干净并检漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是干燥.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有CD(填正确答案标号).
A.圆底烧瓶 B.温度计 C.吸滤瓶
D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是C(填正确答案标号).
A.41% B.50%C.61% D.70%
16.下列关于油脂的叙述不正确的是( )
| A. | 利用油脂在碱性条件下的水解反应,可以生产甘油和肥皂 | |
| B. | 油脂在小肠内受酶的催化作用而水解,生成的高级脂肪酸和甘油作为人体营养成分为肠壁所吸收,同时提供人体活动所需要的能量 | |
| C. | 油脂中的碳链为碳碳单键时,主要是高沸点的动物脂肪 | |
| D. | 油脂是人体所需的基本营养物质之一,应尽量多食用油脂类物质 |
13.设NA表示阿伏加德罗常数,下列说法中正确的是( )
| A. | NA个N2分子和NA个CO2原子个数比为1:1 | |
| B. | 1 mol H2O的质量与NA个H2O质量的总和几乎相等 | |
| C. | 1mol H2所含的原子数为NA | |
| D. | 1mol H2SO4中所含的粒子数目一定是NA |
11.美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是( )
| A. | 氢铝化合物与水反应生成氢氧化铝和氢气 | |
| B. | 氢铝化合物中铝显+3价,氢显-1价 | |
| C. | 铝与水蒸气高温下反应生成氢铝化合物 | |
| D. | 氢铝化合物具有强还原性 |
 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.在汽车排气管内安装催化转化器,可将汽车尾气中主要污染物转化为无毒的大气循环物质.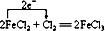 .
.