题目内容
16.下列关于油脂的叙述不正确的是( )| A. | 利用油脂在碱性条件下的水解反应,可以生产甘油和肥皂 | |
| B. | 油脂在小肠内受酶的催化作用而水解,生成的高级脂肪酸和甘油作为人体营养成分为肠壁所吸收,同时提供人体活动所需要的能量 | |
| C. | 油脂中的碳链为碳碳单键时,主要是高沸点的动物脂肪 | |
| D. | 油脂是人体所需的基本营养物质之一,应尽量多食用油脂类物质 |
分析 A.油脂是高级脂肪酸甘油酯;
B.油脂是高级脂肪酸与甘油形成的酯;
C.油脂中的碳链为碳碳单键时,即为饱和脂肪酸甘油酯;
D.过多食用油脂类物质,人体容易发胖.
解答 解:A.油脂在碱性条件下水解生成甘油和高级脂肪酸盐,故A正确;
B.油脂是高级脂肪酸与甘油形成的酯,在体内酶的催化作用下水解,生成相应的羧酸与甘油,故B正确;
C.油脂中的碳链为碳碳单键时,即为饱和脂肪酸甘油酯,主要是高沸点的动物脂肪,故C正确;
D.油脂是人体所需的基本营养物质之一,应适量摄入,过多食用油脂类物质,人体容易发胖,可能引发各种疾病,故D错误.
故选D.
点评 本题考查油脂的性质、组成与结构以及营养物质与人体健康的关系,要注意营养均衡,难度不大.

练习册系列答案
相关题目
10.某学习小组为探究原电池工作原理,设计如图装置,下列叙述不正确的是( )
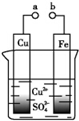

| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e Cu Cu | |
| C. | a和b用导线连接时,Fe为负极,Cu为正极,化学能转化为电能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
7.一定条件下,等物质的量的N2和H2反应达平衡时,NH3的体积分数为40%,则下列叙述不正确的是( )
| A. | N2的转化率为28.57% | B. | H2的转化率为85.7% | ||
| C. | N2的体积分数为20% | D. | H2的体积分数为10% |
4.CaO2难溶于水,溶于酸生成过氧化氢,在医药上用作杀菌剂、防腐剂等.
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)═CaO2(s)+2H2O(l);△H<0
不同浓度的H2O2对反应生成CaO2产率的影响如表:
(1)分析题给信息,解释H2O2浓度大于20%后CaO2产率反而减小的原因:H2O2浓度高,反应速率快,反应放热使体系温度迅速升高,加快H2O2发生分解.
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量.
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2mL盐酸(3mol•L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mL KI溶液(100g•L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后加入指示剂淀粉溶液,用硫代硫酸钠标准溶液继续滴定,直至溶液的蓝色恰好消失且半分钟内颜色不变,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数.滴定时发生的反应为2Na2S2O3+I2═Na2S4O6+2NaI.
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是生成微溶的CaSO4覆盖在过氧化钙表面,使结果不准确.
(3)加入KI溶液后发生反应的离子方程式为H2O2+2I-+2H+═I2+2H2O.
(4)请补充完整实验步骤4中的内容:加入指示剂淀粉溶液;直至溶液的蓝色恰好消失且半分钟内颜色不变.
Ⅰ.CaO2制备原理:Ca(OH)2(s)+H2O2(aq)═CaO2(s)+2H2O(l);△H<0
不同浓度的H2O2对反应生成CaO2产率的影响如表:
| H2O2/% | 5 | 10 | 15 | 20 | 25 | 30 |
| CaO2/% | 62.40 | 63.10 | 63.20 | 64.54 | 62.42 | 60.40 |
Ⅱ.过氧化钙中常含有CaO杂质,实验室可按以下步骤测定CaO2含量.
步骤1:准确称取0.04~0.05g过氧化钙样品,置于250mL的锥形瓶中;
步骤2:分别加入30mL蒸馏水和2mL盐酸(3mol•L-1),振荡使之溶解;
步骤3:向锥形瓶中加入5mL KI溶液(100g•L-1);
步骤4:用硫代硫酸钠标准溶液滴定,至溶液呈浅黄色,然后加入指示剂淀粉溶液,用硫代硫酸钠标准溶液继续滴定,直至溶液的蓝色恰好消失且半分钟内颜色不变,记录数据;
步骤5:平行测定3次,计算试样中CaO2的质量分数.滴定时发生的反应为2Na2S2O3+I2═Na2S4O6+2NaI.
(2)过氧化钙溶解时选用盐酸而不选用硫酸溶液的原因是生成微溶的CaSO4覆盖在过氧化钙表面,使结果不准确.
(3)加入KI溶液后发生反应的离子方程式为H2O2+2I-+2H+═I2+2H2O.
(4)请补充完整实验步骤4中的内容:加入指示剂淀粉溶液;直至溶液的蓝色恰好消失且半分钟内颜色不变.
11.下列有关化学用语的表示正确的是( )
| A. | 甲烷分子的球棍模型: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$ K++H++SO42- |
1.下列各组物质的溶液混合,如果其中酸过量时,仍有沉淀生成的是( )
| A. | NaOH、FeCl3、H2SO4 | B. | HCl、K2CO3、BaCl2 | ||
| C. | CuSO4、HCl、KOH | D. | BaCl2、HNO3、AgNO3 |
5.反应2SO2+O2?2SO3在一定条件下反应一段时间后,SO3的浓度增加了0.8mol/L,在这段时间内用O2表示的反应速率为0.1mol•L-1•s-1,则这段反应时间为( )
| A. | 2.5s | B. | 4s | C. | 5s | D. | 10s |
6.金属材料在日常生活以及生产中有着广泛的应用.下列有关金属及其化合物的说法中正确的是( )
| A. | 金属钠不慎着火,可用泡沫灭火器来灭火或湿布盖灭 | |
| B. | 往FeCl3溶液中滴入KI淀粉溶液,溶液变蓝色 | |
| C. | 铝粉和MgO或Cr2O3粉末混合,高温能发生铝热反应 | |
| D. | 向紫色石蕊试液中加入Na2O2粉末,振荡后溶液变为蓝色并产生气泡 |
 CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂.
CH3Cl为无色,略带臭味的气体,密度为2.25g/L,熔点为-24.2℃,20℃时在水中的溶解度为400mL,易溶于乙醇和丙醇等有机溶剂.