题目内容
11.美、德两国成功合成具有化学特性的氢铝化合物(AlH3)n,关于氢铝化合物的推测不正确的是( )| A. | 氢铝化合物与水反应生成氢氧化铝和氢气 | |
| B. | 氢铝化合物中铝显+3价,氢显-1价 | |
| C. | 铝与水蒸气高温下反应生成氢铝化合物 | |
| D. | 氢铝化合物具有强还原性 |
分析 氢铝化合物性质不稳定能和水反应生成氢氧化铝和氢气,在氧化还原反应中氢铝化合物体现还原性;在化合物中电负性大的显负价,电负性小的元素显正价,据此解答.
解答 解:A.氢铝化合物中氢元素显负价,性质不稳定,易和水反应生成氢氧化铝和氢气而体现还原性,故A正确;
B.在化合物中电负性大的显负价,电负性小的元素显正价,氢元素的电负性大于铝元素,氢铝化合物中铝元素显+3价,氢元素显-1价,故B正确;
C.氢铝化合物易和水反应,所以不能用铝和水蒸气反应制取氢铝化合物,故C错误;
D.氢铝化合物中氢元素显-1价,性质不稳定,易失电子而具有强还原性,故D正确;
故选C.
点评 本题以铝为载体考查铝的化合物的性质,根据元素电负性、元素化合价和性质的关系来分析解答即可,难度不大.

练习册系列答案
相关题目
1.下列各组物质的溶液混合,如果其中酸过量时,仍有沉淀生成的是( )
| A. | NaOH、FeCl3、H2SO4 | B. | HCl、K2CO3、BaCl2 | ||
| C. | CuSO4、HCl、KOH | D. | BaCl2、HNO3、AgNO3 |
2.下列关于反应热的说法正确的是( )
| A. | 已知C(石墨,s)═C(金刚石,s)△H﹦+1.9kJ•mo1-1,说明金刚石具有的能量比石墨低 | |
| B. | 已知H+(aq)+OH-(aq)═H2O(1)△H﹦-57.4KJ•mo1-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量大于28.7kJ | |
| C. | 已知甲烷的燃烧热为890.3kJ•mo1-1,则表示甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H﹦-890.3kJ•mo1-1 | |
| D. | 将0.5mo1N2和1.5mo1H2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H﹦-38.6kJ•mo1-1 |
6.金属材料在日常生活以及生产中有着广泛的应用.下列有关金属及其化合物的说法中正确的是( )
| A. | 金属钠不慎着火,可用泡沫灭火器来灭火或湿布盖灭 | |
| B. | 往FeCl3溶液中滴入KI淀粉溶液,溶液变蓝色 | |
| C. | 铝粉和MgO或Cr2O3粉末混合,高温能发生铝热反应 | |
| D. | 向紫色石蕊试液中加入Na2O2粉末,振荡后溶液变为蓝色并产生气泡 |
16.向含有FeCl3和BaCl2的酸性溶液中通入足量的SO2,有白色沉淀生成,向过滤后的滤液中滴入KSCN溶液,无明显现象,由此得出的正确结论是( )
| A. | 白色沉淀是BaSO3 | B. | 白色沉淀是BaSO3和BaSO4的混合物 | ||
| C. | 白色沉淀是BaSO4 | D. | FeCl3已全部被氧化为FeCl2 |
3.下列实验不能达到目的是( )
| A. | 向25mL沸水中滴加5-6滴稀的FeCl3溶液制备氢氧化铁胶体 | |
| B. | 只用少量水就可鉴别Na2CO3和NaHCO3固体 | |
| C. | 用FeSO4、NaOH和盐酸等试剂在空气中可以制备较纯净的FeCl3溶液 | |
| D. | 用NaOH溶液和盐酸可除去MgCl2溶液中混有的AlCl3 |
20.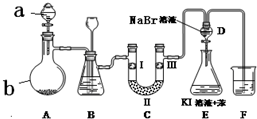 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
(1)a、b两仪器的名称是:a分液漏斗;b圆底烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体 主要成分为Ca(ClO)2和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c.
(5)设计装置D、E的目的是比较氯、溴、碘的非金属性.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为黄色,说明非金属性氯大于溴(填“大于”或“小于”).
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
 实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).
实验室用如图所示装置制备氯气并进行一系列相关的实验(夹持设备已省略).(1)a、b两仪器的名称是:a分液漏斗;b圆底烧瓶.
(2)洗气装置B是为了除去Cl2中的HCl气体,应放入的试剂是饱和食盐水;同时装置B亦是安全瓶,监测实验进行时C中是否发生堵塞,请写出发生堵塞时B中的现象:B中长颈漏斗中液面上升,形成水柱.
(3)制备氯气选用的药品为:漂粉精固体 主要成分为Ca(ClO)2和浓盐酸,相关的化学反应方程式为Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O.
(4)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入c.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 无水氯化钙 | 浓硫酸 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(6)打开活塞,将装置D中少量溶液加入装置E中,振荡.观察到的现象是E中溶液分为两层,上层(苯层、油层或有机层均可)为紫红色.
(7)F处为尾气吸收装置,写出实验室利用烧碱溶液吸收Cl2的离子方程式Cl2+2OH-=Cl-+ClO-+H2O.
1.在四种不同条件下测得反应2SO2+O2?2SO3的反应速如表所示:
其中反应速率最快的是( )
| 编号 | (1) | (2) | (3) | (4) |
| 反应速率[mol/(L.s)] | v(SO2) | v(O2) | v(SO3) | v(O2) |
| 0.4 | 0.25 | 0.5 | 0.3 |
| A. | (1) | B. | (2) | C. | (3) | D. | (4) |
 .
.