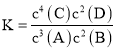题目内容
【题目】硫代硫酸钠(Na2S2O3)可以除去自来水中的氯气,在水产养殖上被广泛应用。用纯碱和硫化碱(主要成分Na2S,含少量Na2SO4、Na2CO3等)为原料制备Na2S2O3·5H2O的实验流程如下:
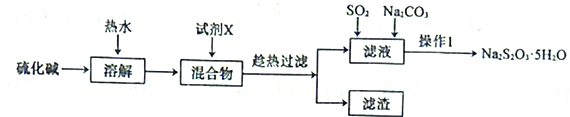
回答下列问题:
(1)试剂X是一种二元化合物的钡盐,它与Na2SO4反应的化学方程式为___________________。
(2)用热水溶解并趁热过滤的目的是______________________。
(3)利用SO2与Na2CO3、Na2S的混合溶液反应制备Na2S2O3,所需仪器如下图:
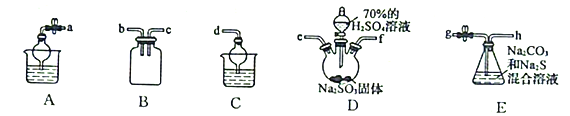
①从左到右连接各仪器,导管的接口顺序为:___________接e、f接___________、___________接___________、___________接d。___________
②E中发生反应的离子方程式为______________________。
③装置B的作用是______________________。
(4)操作1包括蒸发浓缩、______________________、___________、洗涤、干燥
(5)为测定产品Na2S2O3·5H2O的纯度,准确称取12.4gNa2S2O3·5H2O产品,配制成100mL溶液,取25.00mL溶液,以淀粉溶液作指示剂,用0.2500mol·L-1碘的标准溶液滴定,发生反应2S2O32-+I2= S4O62-+2I-,消耗碘的标准溶液20.00mL,则该产品的纯度为___________。
【答案】BaS+Na2SO4= BaSO4+Na2S 更快更多溶解硫化碱,并防止过滤时,因降温而析出Na2S,造成损失 a b c g h CO32-+2 S2-+SO2=3S2O32-+CO2 作安全瓶,防止E中溶液倒吸入D中 冷却结晶 过滤 80%
【解析】
用纯碱和硫化碱(主要成分Na2S,含少量Na2SO4、Na2CO3等)为原料制备Na2S2O3·5H2O,根据实验流程,用热水溶解硫化碱可以更快更多溶解硫化碱,然后加入试剂X,试剂X是一种二元化合物的钡盐,为了不引入新杂质,所以可考虑使用BaS,反应生成硫酸钡、碳酸钡沉淀,过滤除去,然后在滤液中通入二氧化硫,并加入碳酸钠,硫化钠与二氧化硫、碳酸钠反应生成硫代硫酸钠,蒸发浓缩,冷却结晶得到Na2S2O3·5H2O,据此分析解答。
(1)该实验流程的目的是用硫化碱(主要成分Na2S,含少量Na2SO4、Na2CO3等)制备Na2S2O35H2O,原料中含杂质Na2SO4、Na2CO3等,净化时考虑除去SO42-,CO32-,试剂X是一种二元化合物的钡盐,为了不引入新杂质,所以可考虑使用BaS,因此与Na2SO4反应的化学方程式为BaS+Na2SO4= BaSO4↓+Na2S,故答案为:BaS+Na2SO4= BaSO4↓+Na2S;
(2)用热水溶解可以更快更多溶解硫化碱,趁热过滤可以防止过滤时,因降温而析出Na2S,造成损失,故答案为:更快更多溶解硫化碱,并防止过滤时,因降温而析出Na2S,造成损失;
(3)①利用SO2与Na2CO3、Na2S的混合溶液反应制备Na2S2O3,反应的方程式为Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2,根据提供的装置图,D为二氧化硫的发生装置,E为三者的反应装置,尾气中的二氧化硫需要吸收,并防止倒吸,用C装置处理,需按下列顺序连接装置,A(实验后期关闭E中止水夹,打开A中止水夹,可吸收多余SO2)→D(制取SO2)→B(安全装置)→E(制取Na2S2O3)→C(吸收SO2尾气),所以各接口的顺序为: a接e、f接b、c接g、h接d,故答案为:a b c g h;
②E中发生反应的离子方程式为CO32-+2 S2-+SO2=3S2O32-+CO2,故答案为:CO32-+2 S2-+SO2=3S2O32-+CO2;
③装置B是安全瓶,防止E中溶液倒吸入D中,故答案为:作安全瓶,防止E中溶液倒吸入D中;
(4) 硫化钠与二氧化硫、碳酸钠反应生成硫代硫酸钠,要得到硫代硫酸钠晶体,可以蒸发浓缩,冷却结晶得到Na2S2O3·5H2O,因此操作1包括蒸发浓缩、冷却结晶,过滤、洗涤、干燥,最终得到Na2S2O3·5H2O,故答案为:冷却结晶;过滤;
(5) 20.00mL 0.2500mol·L-1碘的标准溶液中含有碘的物质的量为0.02L×0.2500mol/L=0.005mol,根据2S2O32-+I2= S4O62-+2I-,样品中含有的Na2S2O3·5H2O为0.005mol×2×![]() =0.04mol,因此样品中含有的Na2S2O3·5H2O的纯度为
=0.04mol,因此样品中含有的Na2S2O3·5H2O的纯度为![]() ×100%=80%,故答案为:80%。
×100%=80%,故答案为:80%。