题目内容
【题目】现有前四周期T、X、Y、Z、W、M六种元素,已知W、Z、X、T、Y五种非金属元素原子半径依次减小,其中W原子的s电子总数等于p电子总数的2倍,M原子的M能层上有4个未成对电子。请回答下列问题:
(1)写出W、Z、X、T四种元素第一电离能由大到小的顺序:____________(用元素符号表示)。
(2)基态M原子的核外电子排布式为__________________________。
(3)根据VSEPR理论,推断出由W与X两元素组成的最简单二价阴离子的立体构型为____________,W原子的杂化类型为____________。
(4)Y与T、X、Z、W所形成的最简单化合物的沸点由高到低的顺序为__________________________(用化学式表示)。
【答案】)F>N>O>C 1s22s22p63s23p63d64s2(或[Ar]3d64s2) 平面三角形 sp2 H2O>HF>NH3>CH4
【解析】
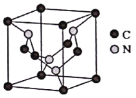
根据题中信息“W原子的s电子总数等于p电子总数的2倍”可知,W的电子排布式是1s22s22p2,则W是碳元素;又知“W、Z、X、T、Y五种非金属元素原子半径依次减小”,根据元素周期律可推知Z是氮元素,X是氧元素,T是氟元素,Y是氢元素;“M原子的M能层上有4个未成对电子”,则M的电子排布式是1s22s22p63s23p63d64s2,即M是铁元素。
(1)C、N、O、F四种元素位于同一周期,随原子序数增大,第一电离能呈增大趋势,但N元素反常,它的第一电离能比O大,但比F小。
(2) 基态M原子的核外电子排布式为1s22s22p63s23p63d64s2或[Ar] 3d64s2;
(3)C和O两种元素组成的最简单的二价阴离子是![]() ,该离子的中心原子的价层电子对数是3,孤电子对数是0,由此可确定其立体构型和杂化类型。
,该离子的中心原子的价层电子对数是3,孤电子对数是0,由此可确定其立体构型和杂化类型。
(4)H与F、O、N、C所形成的最简单化合物分别是HF、H2O、NH3、CH4,其中HF、H2O、NH3分子之间都存在氢键,它们的沸点都比没有氢键的CH4高,常温下H2O为液态,HF、NH3为气态,标准状况下HF为液态,NH3仍为气态,由此可得四种氢化物的沸点由高到低的顺序。
根据题中信息“W原子的s电子总数等于p电子总数的2倍”可知,W的电子排布式是1s22s22p2,则W是碳元素;又知“W、Z、X、T、Y五种非金属元素原子半径依次减小”,根据元素周期律可推知Z是氮元素,X是氧元素,T是氟元素,Y是氢元素;“M原子的M能层上有4个未成对电子”,则M的电子排布式是1s22s22p63s23p63d64s2,即M是铁元素。
(1)C、N、O、F四种元素位于同一周期,随原子序数增大,第一电离能呈增大趋势,但N元素反常,因此第一电离能由大到小的顺序是F>N>O>C;答案为:F>N>O>C;
(2) 基态M原子的核外电子排布式为1s22s22p63s23p63d64s2;答案为:1s22s22p63s23p6或[Ar] 3d64s2;
(3)C和O两种元素组成的最简单的二价阴离子是![]() ,该离子的中心原子的价层电子对数是3,孤电子对数是0,因此其立体构型是平面三角形,C原子的杂化类型为sp2杂化。
,该离子的中心原子的价层电子对数是3,孤电子对数是0,因此其立体构型是平面三角形,C原子的杂化类型为sp2杂化。
(4)H与F、O、N、C所形成的最简单化合物分别是HF、H2O、NH3、CH4,其中HF、H2O、NH3分子之间都存在氢键,它们的沸点都比没有氢键的CH4高,常温下H2O为液态,HF、NH3为气态,标准状况下HF为液态,NH3仍为气态,因此四种氢化物的沸点由高到低的顺序为H2O>HF>NH3>CH4。

 53随堂测系列答案
53随堂测系列答案【题目】下列说法正确的是( )
A.电离平衡常数可以表示弱电解质的相对强弱
B.电离平衡常数受溶液浓度的影响
C.H2CO3的电离常数表达式:K=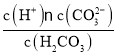
D.电离常数大的酸溶液中c(H+)一定比电离常数小的酸中大
【题目】工业上以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体,其工艺流程如下:

已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO![]() 形式存在且易被氧化。
形式存在且易被氧化。
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | 9.1 | — | — |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 4.7(>10溶解) | 5.6(>9溶解) |
(1)提高酸浸速率的措施有__________________________________(答两条)。
(2)滤渣1的主要成分是_____;滤渣2的主要成分是_____;滤渣3的主要成分是_____。
(3)流程中两次使用了H2O2进行氧化,H2O2的电子式为___________;第一次氧化时反应的离子方程式为_____________________;第二次氧化时目的是____________________。
(4)流程图中“ ”内的操作是________________、洗涤、干燥。
(5)除去酸性废水中含有的Cr2O72-可以使用FeSO4,测得反应后的溶液中含Cr3+、Fe2+、Fe3+、H+等阳离子。该反应的离子方程式为_________________________________。