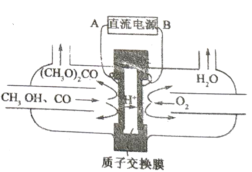
题目内容
【题目】早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成,回答下列问题:
(1)准晶是一种无平移周期序,但有严格准周期位置序的独特晶体,可通过_______方法区分晶体、准晶体和非晶体。
(2)基态铜原子的电子排布式为_______。
(3)CuO在高温时分解为O2和Cu2O,请从阳离子的结构来说明在高温时,Cu2O比CuO更稳定的原因是_______。Cu2O为半导体材料,在其立方晶胞内部有4个氧原子,其余氧原子位于面心和顶点,则该晶胞中有_______个铜原子。
(4)Cu2+能与乙二胺(H2N—CH2—CH2—NH2)形成配离子如图:![]() ,该配离子中含有的化学键类型有______(填字母序号)。
,该配离子中含有的化学键类型有______(填字母序号)。
A.配位键 B.极性键 C.离子键 D.非极性键
(5)羰基铁[Fe(CO)5]可用作催化剂、汽油抗暴剂等。1molFe(CO)5分子中含____molσ键,与CO互为等电子体的离子是__(填化学式,写一种)。
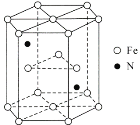
(6)某种磁性氮化铁的结构如图所示,N随机排列在Fe构成的正四面体空隙中。正六棱柱底边长为acm,高为ccm,阿伏加德罗常数的值为NA,则该磁性氮化铁的晶体密度为____g/cm3(列出计算式)。
【答案】X-射线衍射 1s22s22p63s23p63d104s1 Cu2O中的Cu+3d轨道处于全满的稳定状态,而CuO中Cu2+中3d轨道排布为3d9,能量高,不稳定 16 ABD 10 CN-(或C22-) ![]()
【解析】
(1)晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间;
(2)根据构造原理可书写出基态铜原子的电子排布式;
(3)根据原子核外电子的轨道上电子处于全满、半满或全空时是稳定状态分析;结合O原子数目及Cu2O中Cu和O的比例计算晶胞中Cu原子的数目;
(4)Cu2+与乙二胺(H2N-CH2-CH2-NH2)中N原子形成配位键,H2N-CH2-CH2-NH2中C原子之间形成非极性键、不同原子之间形成极性键;单键为σ键,C原子没有孤电子对、形成4个σ键,杂化轨道数目为4;
(5) Fe与CO形成5个配位键,属于σ键,CO分子中形成1个σ键,据此计算Fe(CO)5分子含有的σ键数目是10个;与CO互为等电子体的离子,含有2个原子、价电子总数为10,可以用N原子与1个单位负电荷替换O原子,也可以用C原子与2个单位负电荷替换O原子;
(6)计算结构单元中原子总质量、晶胞体积,利用ρ=![]() 计算晶体密度。
计算晶体密度。
(1)从外观无法区分三者,但用X光照射会发现:晶体对X射线发生衍射,非晶体不发生衍射,准晶体介于二者之间,因此通过有无X-射线衍射现象即可确定;
(2) 29号元素Cu元素的基态原子核外电子排布式为1s22s22p63s23p63d104s1;
(3)在Cu2O中Cu+原子的核外电子排布为1s22s22p63s23p63d10,处于d轨道的全满的稳定状态,而若再失去1个电子变为Cu2+时1s22s22p63s23p63d9,是不稳定的状态,CuO在高温时分解为O2和Cu2O;该晶胞中O原子数为4×1+6×![]() +8×
+8×![]() =8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,所以该晶胞中含有Cu原子个数为16个;
=8,由Cu2O中Cu和O的比例可知该晶胞中铜原子数为O原子数的2倍,所以该晶胞中含有Cu原子个数为16个;
(4) Cu2+与乙二胺(H2N-CH2-CH2-NH2)中N原子形成配位键;在配位体H2N-CH2-CH2-NH2中C原子与C原子之间形成非极性键;不同元素的原子之间形成极性键,所以该配离子中存在的化学键类型为配位键、极性键、非极性键,故合理选项是ABD;
(5) Fe与CO形成5个配位键,属于σ键,CO分子中形成1个σ键,故Fe(CO)5分子含有10个 σ键,1mol Fe(CO)5分子中含10molσ键,与CO互为等电子体的离子,含有2个原子、价电子总数为10,可以用N原子与1个单位负电荷替换O原子,也可以用C原子与2个单位负电荷替换O原子,与CO互为等电子体的离子为:CN-、C22-等;
(6)图中结构单元底面为正六边形,边长为a nm,底面面积为6×![]() ×a×10-7 cm×a×10-7 cm×sin60°=
×a×10-7 cm×a×10-7 cm×sin60°=![]() cm2;结构单元的体积V=
cm2;结构单元的体积V=![]() cm2×c×10-7 cm=
cm2×c×10-7 cm=![]() cm3,结构单元中含有
cm3,结构单元中含有![]() =6,该晶胞在原子总质量m=
=6,该晶胞在原子总质量m=![]() g,所以该晶体密度ρ=
g,所以该晶体密度ρ=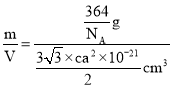 =
=![]() g/cm3。
g/cm3。