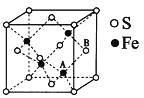
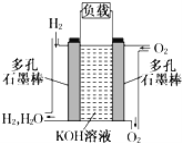
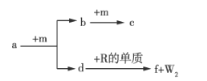
题目内容
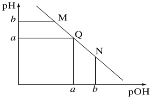
【题目】常温下,向1L 0.1mol·L1一元酸HR溶液中逐渐通入氨气(已知常温下NH3·H2O电离平衡常数K=1.76×10-5),使溶液温度和体积保持不变,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是
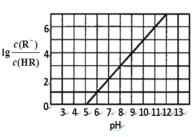
A.当c(R-)=c(HR)时,溶液必为中性
B.0.1mol·L-1HR溶液的pH为5
C.HR为弱酸,常温时随着氨气的通入,![]() 逐渐增大
逐渐增大
D.当通入0.1 mol NH3时,c(NH4+)>c(R-)>c(OH-)>c(H+)
【答案】D
【解析】
A.当c(HR)=c(R)时,lg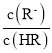 = lg1=0,如图所示,溶液的pH=5,溶液呈酸性,故A错误;
= lg1=0,如图所示,溶液的pH=5,溶液呈酸性,故A错误;
B.Ka=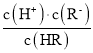 ,当lg
,当lg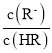 =0时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L,则溶液中c(H+)=
=0时,c(R)=c(HR),Ka=c(H+)=105mol/L,因为弱酸部分电离,则溶液中c(H+)≈c(R),c(HR)≈0.1mol/L,则溶液中c(H+)=![]() =
=![]() mol/L=103mol/L,溶液的pH=3,故B错误;
mol/L=103mol/L,溶液的pH=3,故B错误;
C.![]() =
=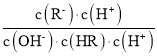 =
=![]() ,电离平衡常数、离子积常数都只与温度有关,温度不变,电离平衡常数及离子积常数不变,则
,电离平衡常数、离子积常数都只与温度有关,温度不变,电离平衡常数及离子积常数不变,则![]() 不变,故C错误;
不变,故C错误;
D.由B项可得,HR的电离平衡常数Ka=105mol/L,当通入0.1molNH3时,反应恰好生成NH4R,NH4+的水解平衡常数为Kh(NH4+)=![]() =5.68×1010,HR水解平衡常数Kh(R)=
=5.68×1010,HR水解平衡常数Kh(R)=![]() =109>5.68×1010,所以NH4+的水解程度小于R的水解程度,溶液呈碱性,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH)+c(R),由于c(OH)>c(H+),所以c(NH+4)>c(R),则溶液中离子浓度大小为c(NH4+)>c(R)>c(OH)>c(H+),故D正确;
=109>5.68×1010,所以NH4+的水解程度小于R的水解程度,溶液呈碱性,溶液中存在电荷守恒:c(NH4+)+c(H+)=c(OH)+c(R),由于c(OH)>c(H+),所以c(NH+4)>c(R),则溶液中离子浓度大小为c(NH4+)>c(R)>c(OH)>c(H+),故D正确;
答案选D。

练习册系列答案
相关题目