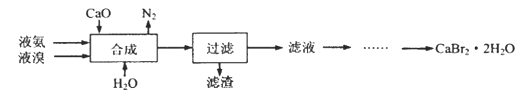
题目内容
【题目】下列化学(或离子)方程式不正确的是( )
A.NaHS溶液存在电离平衡:HS-+H2O![]() S2-+H3O+
S2-+H3O+
B.用碳酸钠溶液浸泡锅炉水垢:CO32-+CaSO4===CaCO3+SO42-
C.Ca(OH)2在水溶液中电离:Ca(OH)2===Ca2++2OH-
D.将明矾放入浑浊的河水中,可使水澄清:Al3++3H2O===Al(OH)3↓+3H+
【答案】D
【解析】
试题分析:A、HS-+H2O![]() S2-+H3O+,故说法正确;B、CaSO4微溶于水,CaCO3难溶于水,利用反应向着更难溶的方向进行,故说法正确;C、Ca(OH)2属于强碱,在水溶液中完全电离,故说法正确;D、明矾净水是因为Al3+水解生成Al(OH)3胶体,水解方程式:Al3++3H3O
S2-+H3O+,故说法正确;B、CaSO4微溶于水,CaCO3难溶于水,利用反应向着更难溶的方向进行,故说法正确;C、Ca(OH)2属于强碱,在水溶液中完全电离,故说法正确;D、明矾净水是因为Al3+水解生成Al(OH)3胶体,水解方程式:Al3++3H3O![]() Al(OH)3+3H+,故说法错误。
Al(OH)3+3H+,故说法错误。

【题目】环乙烯是一种重要的化工原料,实验室常用下列反应制备环乙烯:

环己醇、环己烯的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
环己烯 | 83(70.8)* | 0.8085 | 不溶于水 |
*括号中的数据表示该有机物与水形成的具有固定组成的混合物中有机物的质量分数
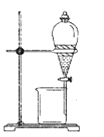
Ⅰ:制备环己烯粗品。实验中将环己醇与浓硫酸混合加入烧瓶中,按图所示装置,油浴加热,蒸馏约1h,收集馏分,得到主要含环己烯和水的混合物。

Ⅱ:环己烯的提纯。主要操作有;
a.向馏出液中加入精盐至饱和;
b.加入3~4mL5%Na2CO3溶液;
c.静置,分液;
d.加入无水CaCl2固体;
e.蒸馏
回答下列问题:
(1)油浴加热过程中,温度控制在90℃以下,蒸馏温度不宜过高的原因是________。
(2)蒸馏不能彻底分离环己烯和水的原因是_______________。
(3)加入精盐至饱和的目的是_____________________。
(4)加入3~4mL5%Na2CO3溶液的作用是__________。
(5)加入无水CaCl2固体的作用是______________。
(6)利用核磁共振氢谱可以鉴定制备的产物是否为环己烯,环己烯分子中有_______种不同环境的氢原子。
【题目】如图所示,室温时甲、乙两个容积相等的烧瓶中分别集满了两种气体(同温、同压),当取下止水夹K,使两瓶内气体充分接触后,容器内压强最小的是( )
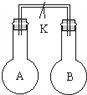
编号 | A | B | C | D |
甲中气体 | H2S | H2 | NH3 | NO |
乙中气体 | SO2 | Cl2 | HCl | O2 |
A. A B. B C. C D. D