题目内容
19.两种气态烃的混合物共0.1mol,完全燃烧后得3.36L(标准状况)CO2和3.6克水,下列说法正确的是( )| A. | 一定有乙烯 | B. | 一定有甲烷 | ||
| C. | 可能有乙烷 | D. | 一定是甲烷和乙烯的混合物 |
分析 标况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,则混合的平均化学式为,C1.5H4,由于是混合物,则肯定含有C原子数小于1.5的烃,即一定含有甲烷,因甲烷中含有4个氢原子,则另一种烃也含有4个氢原子,以此进行解答.
解答 解:标况下3.36L二氧化碳的物质的量为:n(CO2)=$\frac{3.36L}{22.4L/mol}$=0.15mol,3.6g水的物质的量为:n(H2O)=$\frac{3.6g}{18g/mol}$=0.2mol,
1mol混合气体完全燃烧生成1.5mol二氧化碳、2mol水,则混合的平均化学式为:C1.5H4,
由于两种气态烃的混合物,则一定含有C原子数小于1.5的烃,所以一定含有甲烷,
又由于甲烷中含4个氢原子,则另一种烃也含有4个氢原子,
根据以上分析可知,混合气体中一定含有甲烷,所以B正确;可能含有乙烯、丙炔,一定不含乙烷,所以A、C、D错误,
故选B.
点评 本题考查了有机物分子式的计算,题目难度中等,注意掌握利用平均分子组成判断烃的组成的方法,明确确定有机物组成时常用方法:平均碳法、平均氢法、平均碳氢分子式法、平均式量法等.

练习册系列答案
相关题目
9.下列离子方程式正确的是( )
| A. | 在氢氧化钡溶液中加入过量的小苏打Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| B. | 在氢氧化钾的稀溶液中通入过量的二氧化硫气体 SO2+OH-═HSO3- | |
| C. | 氯气通入水中Cl2+H2O═2H++Cl-+ClO- | |
| D. | 在氢氧化钠溶液中通入过量的H2S H2S+2OH-═S2-+2H2O |
7.盛放下列试剂的试剂瓶不能用玻璃塞的是( )
| A. | 氢氧化钾溶液 | B. | 稀硫酸 | C. | 新制氯水 | D. | 氯化钙溶液 |
4.下列属于同素异形体的一组物质是( )
| A. | 12C和14C | B. | 氯气和液氯 | ||
| C. | 乙醇和二甲醚(CH3-O-CH3) | D. | N2和N4 |
11.下列有机反应中,不属于取代反应的是( )
| A. |  +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$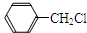 +HCl +HCl | |
| B. | CH3CH2CH2OH+CuO$\stackrel{△}{→}$CH3CH2CHO+H2O+Cu | |
| C. | CH2=CHCH2Cl+NaOH$→_{△}^{H_{2}O}$CH2=CHCH2OH+NaCl | |
| D. | 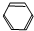 +HO-NO2$→_{50-60℃}^{浓H_{2}SO_{4}}$ +HO-NO2$→_{50-60℃}^{浓H_{2}SO_{4}}$ +H2O +H2O |
9.在Na2CO3溶液中,下列关系正确的是( )
| A. | c(OH-)=c(H2CO3)+c(HCO3-) | B. | 2c(Na+)=c(H2CO3)+c(HCO3-)+c(CO32-) | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(HCO3-) | D. | c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+(OH-) |
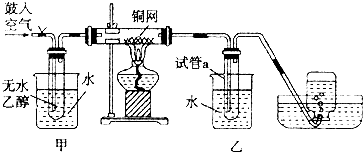
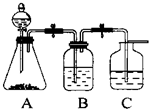 设计一个简单的一次性完成实验的装置图,验证醋酸溶液,二氧化碳水溶液,苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.
设计一个简单的一次性完成实验的装置图,验证醋酸溶液,二氧化碳水溶液,苯酚溶液的酸性强弱顺序是CH3COOH>H2CO3>C6H5OH.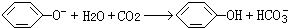 .
.