题目内容
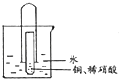
【题目】2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,充放电时AlCl4—和Al2Cl7—两种离子在Al电极上相互转化,其它离子不参与电极反应,其放电工作原理如右图所示。下列说法正确的是

A. 放电时,有机阳离子向铝电极方向移动
B. 充电时,外加电源时铝连正极、石墨连负极
C. 放电时负极的电极反应为:4![]() =Al-3e-+7
=Al-3e-+7![]()
D. 该电池的工作原理为:Al+4![]() +3CnAlCl4
+3CnAlCl4  3Cn+4
3Cn+4![]()
【答案】D
【解析】A、放电时,活泼的金属铝是负极,不活泼石墨为正极,放电时,有机阳离子向正极石墨电极方向移动,故A错误;B、充电时,铝电极是阴极连接外加电源的负极,石墨电极是阳极连接外加电源的正极,故B错误;C、放电时,活泼的金属铝是负极,电极反应为:Al-3e-+7AlCl4-=4Al2Cl7-,故C错误;D、放电时负极发生氧化反应生成铝离子,铝离子与AlCl4-结合生成Al2Cl7-,所以电极反应式为:Al-3e-+7AlCl4-═4Al2Cl7-,正极上电极反应式为:CnAlCl4+e-═Cn+AlCl4-,两极反应相加得到总反应:3CnAlCl4+Al+4AlCl4-  4Al2Cl7-+3Cn,故D正确;故选D。
4Al2Cl7-+3Cn,故D正确;故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
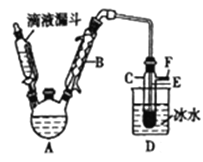
小学生10分钟应用题系列答案【题目】下图是实验室用乙醇与浓硫酸和溴化钠反应来制备溴乙烷的装置,反应需要加热,图中省去了加热装置。有关数据见下表。
乙醇 | 溴乙烷 | 溴 | |
状态 | 无色液体 | 无色液体 | 深红棕色液体 |
密度/g.cm-3 | 0.79 | 1.44 | 3.1 |
沸点/℃ | 78.5 | 38.4 | 59 |
(1)制备操作中,加入的浓硫酸必须进行稀释,其目的是_____(填字母)。
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(2)己知加热温度较低时NaBr与硫酸反应生成NaHSO4,写出加热时A中发生的主要反应的化学方程式:________________。
(3)仪器B的名称是________,冷却水应从B的____(填“上“或“下")口流进。
(4)反应生成的溴乙烷应在______(填“A"或"C")中。
(5)若用浓的硫酸进行实验时,得到的溴乙烷呈棕黄色,最好选择下列_____(填字母)溶液来洗涤产品。
a氢氧化钠 b.碘化亚铁 c.亚硫酸钠 d.碳酸氢钠
洗涤产品时所需要的玻璃仪器有_______________。