题目内容
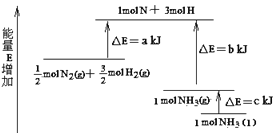
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)CO(g)+H2O(g),其化学平衡常数K和温度t的关系如表:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___。已知:K1000℃>K800℃,则该反应是__反应。(填“吸热”或“放热”);
(2)已知在800℃时,该反应的平衡常数K1=0.9,则该温度下反应CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数K2=___。
CO2(g)+H2(g)的平衡常数K2=___。
(3)能判断该反应是否达到化学平衡状态的依据是__。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:c(CO2)c(H2)=c(CO)c(H2O),试判断此时的温度为__℃。
【答案】 吸热 1.11或
吸热 1.11或![]() BC 830
BC 830
【解析】
(1)根据K为生成物浓度幂之积与反应物浓度幂之积的比,结合温度对平衡的影响分析判断;
(2)根据正逆反应的平衡常数K互为倒数的关系计算;
(3)结合平衡的特征“等、定”及衍生的物理量判断;
(4)根据K为生成物浓度幂之积与反应物浓度幂之积的比,结合表格数据计算判断。
(1)CO2 (g)+H2(g)CO (g)+H2O (g)的平衡常数表达式K= ,已知:K1000℃>K800℃,温度越高,K越大,说明升高温度,平衡正向移动,正反应为吸热反应;
,已知:K1000℃>K800℃,温度越高,K越大,说明升高温度,平衡正向移动,正反应为吸热反应;
故答案为: ;吸热;
;吸热;
(2)已知在800℃时,CO2(g)+H2(g)CO(g)+H2O(g),该反应的平衡常数K1=0.9,CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K2=![]() =
=![]() =
=![]() =1.11;
=1.11;
故答案为:1.11或![]() ;
;
(3) CO2(g)+H2(g)CO(g)+H2O(g),正反应为吸热反应;
A.该反应为气体体积不变的反应,容器中气体的压强始终不变,不能判定为平衡状态,故A不选;
B.混合气体中c(CO)不变,符合平衡特征“定”,说明达到平衡状态,故B选;
C.v正(H2)=v逆(H2O),符合平衡特征“等”,说明达到平衡状态,故C选;
D.c(CO2)=c(CO),二者浓度相等时与起始量、转化率有关,不能判定平衡状态,故D不选;
故答案为:BC;
(4)某温度下,平衡浓度符合下式:c (CO2)c (H2)=c (CO)c(H2O),则K= =1,结合表中数据可知,该温度为830℃;
=1,结合表中数据可知,该温度为830℃;
故答案为:830。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】利用下图装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.25 mol/L硫酸倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶液,并测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度。
回答下列问题:
(1)倒入NaOH溶液的正确操作是_________
A.沿玻璃棒缓慢倒入 B.分三次少量倒入 C.一次迅速倒入
(2)使硫酸与NaOH溶液混合均匀的正确操作是__________
A.用温度计小心搅拌 B.揭开硬纸片用玻璃棒搅拌 C.轻轻地振荡烧杯 D.用套在温度计上的环形玻璃棒上下轻轻地抽动
(3)实验数据如下表:
温度 实验次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 27.0 | 27.4 | 27.2 | 32.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.2 | |
4 | 26.4 | 26.2 | 26.3 | 29.8 | |
①根据表中数据计算出来温度差的平均值为______℃;
②近似认为0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容c=4.18 J/(g·℃)。则中和热ΔH=_______( 取小数点后一位)。
③上述实验数值结果与中和热为57.3 kJ/mol有偏差,产生偏差的原因可能是____。
a.实验装置保温、隔热效果差 b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度 c.量取NaOH溶液的体积时仰视读数 d.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
【题目】苯胺为无色液体,还原性强,易被氧化;有碱性,与酸反应生成盐。常用硝基苯与H2制备:
![]() +3H2
+3H2![]()
![]() +2H2O。
+2H2O。
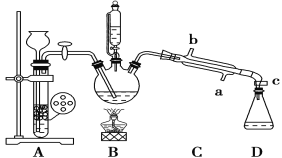
其部分装置及有关数据如下:
项目 | 沸点/℃ | 密度(g/mL) | 溶解性 |
硝基苯 | 210.9 | 1.20 | 不溶于水,易溶于乙醇、乙醚 |
苯胺 | 184.4 | 1.02 | 微溶于水,易溶于乙醇、乙醚 |
乙醚 | 34.6 | 0.71 | 不溶于水,易溶于硝基苯、苯胺 |
实验步骤:
①检查装置的气密性,连接好C处冷凝装置的冷水。
②先向三颈烧瓶中加入沸石及硝基苯,再取下恒压分液漏斗,换上温度计。
③打开装置A、B间活塞,通入H2一段时间。
④点燃B处的酒精灯,加热,使温度维持在140℃进行反应。
⑤反应结束后,关闭装置A、B间活塞,加入生石灰。
⑥调整好温度计的位置,继续加热,收集182~186 ℃馏分,得到较纯苯胺。
回答下列问题:
(1)步骤⑥中温度计水银球的位置在________。
(2)下列关于实验的叙述中,错误的是________。
A.冷凝管的冷水应该从b进从a出
B.实验开始时,温度计水银球应插入反应液中,便于控制反应液的温度
C.装置A中应使用锌粉,有利于加快生成H2的速率
D.加入沸石的目的是防止暴沸
(3)若实验中步骤③和④的顺序颠倒,则实验中可能产生的后果是_______。
(4)蒸馏前,步骤⑤中加入生石灰的作用是_______。
(5)有学生质疑反应完成后,直接蒸馏得到苯胺的纯度不高,提出以下流程:
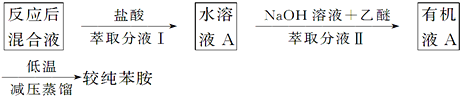
苯胺在酸性条件下生成盐酸苯胺被水萃取,在碱性溶液中又被放有机溶剂反萃取,这种萃取——反萃取法简称反萃。实验中反萃的作用是___;在分液漏斗中进行萃取分液时,应注意不时放气,其目的是____。