题目内容
1.下列物质中,只含有离子键,不含有共价键的是( )| A. | CaCl2 | B. | KOH | C. | HCl | D. | NH4 NO3 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,据此分析解答.
解答 解:A.氯化钙中钙离子和氯离子之间只存在离子键,不含共价键,故A正确;
B.KOH中钾离子和氢氧根离子之间存在离子键、O-H原子之间存在共价键,故B错误;
C.HCl分子中H-Cl原子之间只存在共价键,不含离子键,故C错误;
D.硝酸铵中铵根离子和硝酸根离子之间存在离子键、铵根离子中N-H原子之间和硝酸根离子中N-O原子之间存在共价键,故D错误;
故选A.
点评 本题考查离子键和共价键,侧重考查基本概念,明确离子键和共价键的区别是解本题关键,注意所有的铵盐中都含有离子键,为易错点.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
12.短周期主族元素X、Y、Z在元素周期表中的相对位置如图所示.下列说法不正确的是( )


| A. | 原子半径:Y>Z>X | |
| B. | 若Y的氧化物为两性氧化物,则Z的一种单质在空气中易自燃 | |
| C. | 若X的气态氢化物与Z的最高价氧化物的水化物能反应,则生成的盐仅有一种 | |
| D. | 若Y与Z的核电荷数之和为X的4倍,则X、Y、Z的氢化物分子的立体构型分别为:V形,三角锥形,直线形 |
9.已知N2和H2合成氨的反应是放热反应,破坏1mol N≡N键消耗的能量为Q1kJ,破坏1mol H-H键消耗的能量为Q2kJ,形成1mol N-H键放出的能量为Q3kJ,下列关系式中正确的是( )
| A. | Q1+3Q2>6Q3 | B. | Q1+3Q2<6Q3 | C. | Q1+Q2<Q3 | D. | Q1+Q2=Q3 |
6.下列各组中化合物的性质比较,不正确的是( )
| A. | 酸性:HClO4>HBrO4>HIO4 | B. | P、S、C1元素最高正价依次升高 | ||
| C. | 稳定性:PH3>H2S>HCl | D. | 离子半径:Mg2+<Na+<F- |
10.下列有关化学用语的表示正确的是( )
| A. | 聚2-甲基-1,3-丁二烯的结构简式: | B. | 间羟基苯甲酸的结构简式: | ||
| C. | N3-的结构示意图: | D. | 氯化钡的电子式: |
11.下列说法中,正确的是( )
| A. | IA和VIIA族元素间可形成共价化合物 | |
| B. | 第二周期:从左到右最高价从+1到+7 | |
| C. | 同主族的单核阴离子:还原性越强,水解程度越大 | |
| D. | 同周期金属:原子失电子能力越强,最高化合价越高 |
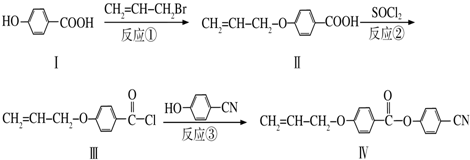
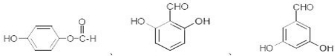 任一种.
任一种.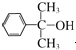 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ.Ⅴ的结构简式是 .
.
 ,它可能的结构数目是( )
,它可能的结构数目是( )