题目内容
5.下列有关因果关系的描述正确的是( )| A. | 因为盐酸的酸性强于氢硫酸,所以氯元素的非金属性强于硫 | |
| B. | 因为醋酸电离吸热,所以用NaOH溶液恰好中和等体积等浓度的醋酸和盐酸,前者放出热量少 | |
| C. | 钠的金属性比钾强,工业上用钠制取钾(Na+KCl?K↑+NaCl) | |
| D. | 因为某吸热反应能自发进行,所以该反应是熵减反应 |
分析 A.元素的非金属性越强,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强,与氢化物的酸性强弱无关;
B.醋酸电离是吸热过程,酸碱中和反应是放热反应;
C.Na的金属性比K弱,Na的沸点高于K;
D.△H-T△S<0的反应能够自发进行.
解答 解:A.元素的非金属性越强,其氢化物的稳定性越强,其最高价氧化物的水化物酸性越强,与氢化物的酸性强弱无关,所以不能根据氢化物水溶液酸性强弱判断非金属性强弱,故A错误;
B.醋酸电离是吸热过程,酸碱中和反应是放热反应,HCl是强电解质,所以用NaOH溶液恰好中和等体积等浓度的醋酸和盐酸,醋酸电离吸收部分热量,所以前者放出热量少,故B正确;
C.Na的金属性比K弱,在850℃时使K蒸汽分离出,而钠为液体,可用钠制取钾,利用的是高沸点金属制备低沸点金属,故C错误;
D.△H>0的反应能够自发进行时,△S必须大于0,所以为熵增的反应,故D错误;
故选B.
点评 本题考查非金属性强弱判断、中和反应、熵变等知识点,侧重考查学生分析判断能力,注意非金属性强弱与氢化物水溶液酸性强弱无关,易错选项是A.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.下列化学用语表达正确的是( )
| A. | 氮气的电子式 | B. | 乙烯的结构简式 CH2CH2 | ||
| C. | 次氯酸的电子式 | D. | 苯分子的比例模型  |
16.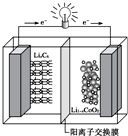 某种可充电聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6═6C+LiCoO2,其工作原理示意图如图.下列说法不正确的是( )
某种可充电聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6═6C+LiCoO2,其工作原理示意图如图.下列说法不正确的是( )
 某种可充电聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6═6C+LiCoO2,其工作原理示意图如图.下列说法不正确的是( )
某种可充电聚合物锂离子电池放电时的反应为:Li1-xCoO2+LixC6═6C+LiCoO2,其工作原理示意图如图.下列说法不正确的是( )| A. | 放电时LixC6发生氧化反应 | |
| B. | 充电时将电池的负极与外接电源的负极相连 | |
| C. | 充电时,Li+通过阳离子交换膜从左向右移动 | |
| D. | 放电时,电池的正极反应为Li1-xCoO2+xLi++xe-═LiCoO2 |
13.下列对难溶电解质的溶解平衡的叙述,错误的是( )
| A. | 难溶电解质的溶解平衡是一种动态平衡 | |
| B. | 达到溶解平衡时,沉淀的速率和溶解的速率相等,溶液中离子的浓度保持不变 | |
| C. | 达到溶解平衡时,溶液中各种离子的浓度不一定相等 | |
| D. | 达到溶解平衡时,再加入该难溶电解质,将促进其溶解 |
20.某鱼雷采用Al-Ag2O动力电池,以溶解有氢氧化钾的流动海水为电解液,电池反应为:2Al+3Ag2O+2KOH═6Ag+2KAlO2+H2O,下列说法不正确的是( )
| A. | Ag2O为电池的正极 | B. | Al在电池反应中被氧化 | ||
| C. | 电子由Ag2O极经外电路流向Al极 | D. | 溶液中的OH-向Al极迁移 |
10.下列分子式所表示的物质的同分异构体数目最多的是(不考虑立体异构)( )
| A. | CH2Cl2 | B. | C2H2Cl2 | C. | C4H8 | D. | C3H7Cl |
17.下列过程吸收热量的是( )
| A. | 硝酸铵和适量的水混合 | B. | 氧化钙和适量的水混合 | ||
| C. | 稀盐酸与金属镁反应 | D. | 汽油在空气中燃烧 |
14.从石器、青铜器到铁器时代,金属的冶炼体现了人类文明的发展水平.图表示了三种金属被人类开发利用的大致年限,之所以有先后,主要取决于( )
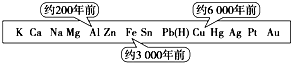

| A. | 金属的导电性强弱 | B. | 金属在地壳中的含量多少 | ||
| C. | 金属的活动性大小 | D. | 金属的化合价高低 |
15.将a g 含NaOH样品溶解在b mL 0.1mol/L的硫酸中(杂质不反应),再加入c mL 0.1mol/L的氢氧化钡溶液,反应后所得溶液恰好呈中性,则样品中NaOH的纯度是( )
| A. | $\frac{b-c}{125a}$×100% | B. | $\frac{b-2c}{125a}$×100% | C. | $\frac{b-c}{250a}$×100% | D. | $\frac{8b-8c}{a}$×100% |