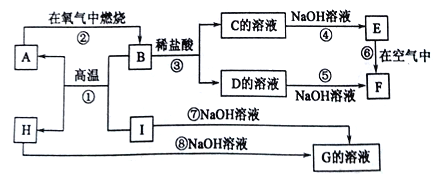
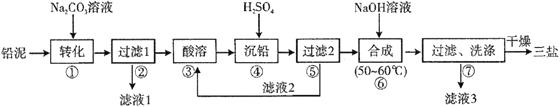
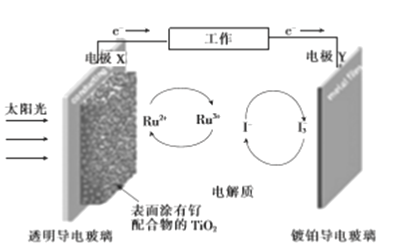
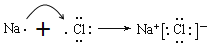题目内容
【题目】铁、铜的单质及它们的化合物与我们的生产、生活紧密相关。
(1)Cu处于周期表中______区,其最高能层的符号为______,基态铜原子的价电子排布式为________。
(2)向硫酸铜溶液中逐滴滴加氨水,首先形成蓝色沉淀,继续滴加氨水。沉淀溶解,得到深蓝色透明溶液,向深蓝色溶液中加入乙醇,析出深蓝色晶体。
①写出沉淀溶解,得到深蓝色透明溶液的离子方程式:________。
②为什么加入乙醇,能够析出深蓝色晶体?________________
③为什么NH3常在配合物中作配体,而NH4+却不能作配体?_______。
(3)Fe3+可以与SCN-、CN-、H2NCONH2(尿素)等多种配体形成很多的配合物。
①请写出一种与SCN-互为等电子体的分子:________。
②CN-的电子式为________。
③H2NCONH2(尿素)中N、C原子的杂化方式分别为_______、_______,组成尿素的4种元素的第一电离能由大到小的顺序为__________。
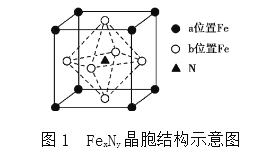
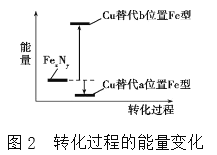
(4)某FeN,的晶胞如图1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n)CunNy。FexNy转化为两种Cu替代型产物的能量变化如图2所示,其中更稳定的Cu替代型产物的化学式为________。
【答案】 ds N 3d104s1 Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- 乙醇的极性小于水,在溶液中加入乙醇能够减小溶剂的极性,降低[Cu(NH3)4]SO4的溶解度 NH3中N原子能够提供孤电子对,而NH4+中N原子价电子层无孤电子对 CO2(或CS2、N2O、BeCl2) ![]() sp3 sp2 N>O>C>H Fe3CuN
sp3 sp2 N>O>C>H Fe3CuN
【解析】考查物质结构与性质的运用,(1)Cu的价电子排布式为3d104s1,位于第四周期IB族,属于ds区;最高能层符号为N;Cu属于副族元素,价电子包括最外层电子,以及次外层的d能级,即基态铜原子的价电子排布式为3d104s1;(2)①发生的反应是CuSO4+2NH3·H2O=Cu(OH)2↓+2NH4+,继续加入NH3·H2O,发生Cu(OH)2+4NH3=[Cu(NH3)4](OH)2,即深蓝色透明溶液为[Cu(NH3)4](OH)2,其离子方程式为 Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH- ;②乙醇的极性小于水,在溶液中加入乙醇能够减小溶剂的极性,降低[Cu(NH3)4]SO4的溶解度;③形成配位键,一方提供孤电子对,一方提供空轨道,NH3中N原子能够提供孤电子对,而NH4+中N原子价电子层无孤电子对;(3)①根据等电子体的定义,与SCN-互为等电子体的分子是 CO2(或CS2、N2O、BeCl2);②CN-中C和N之间共用三键―即CN-的电子式为![]() ;③尿素的结构简式为
;③尿素的结构简式为 ,C的杂化类型为sp2,N的杂化类型为sp3;同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此第一电离能大小顺序是N>O>C>H;(4)能量越低,物质越稳定,即铜替代a位置Fe,即Cu的个数为8×1/8=1,Fe位于面心,个数为6×1/2=3,N位于体心,化学式为Fe3CuN。
,C的杂化类型为sp2,N的杂化类型为sp3;同周期从左向右第一电离能增大,但IIA>IIIA,VA>VIA,因此第一电离能大小顺序是N>O>C>H;(4)能量越低,物质越稳定,即铜替代a位置Fe,即Cu的个数为8×1/8=1,Fe位于面心,个数为6×1/2=3,N位于体心,化学式为Fe3CuN。

 一课一练课时达标系列答案
一课一练课时达标系列答案