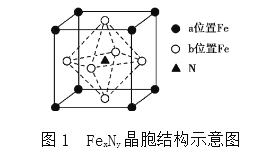
题目内容
【题目】三种正盐的混合溶液中含有0.2molNa+ , 0.25molMg2+ , 0.4molCl﹣ , 则SO42﹣的物质的量为( )
A.0.1 mol
B.0.3 mol
C.0.5 mol
D.0.15 mol
【答案】D
【解析】解:溶液呈电中性,根据电荷守恒有n(Na+)+2n(Mg2+)=n(Cl﹣)+2n(SO42﹣),故
0.2mol×1+0.25mol×2=1×0.4mol+2n(SO42﹣)
解得:n(SO42﹣)=0.15mol,
故选D.

【题目】天然气是一种重要的化工原料,可用来生产氢气和甲醇等高附加值化学品。回答下列问题:
(1)以天然气为原料制取氢气是工业上常用的制氢方法。
已知:
①CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH1=a kJ·mol-1
②CH4(g)+CO2(g) =2CO(g)+2H2(g) ΔH2=b kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3
请计算上述反应中的反应热ΔH3=_________(用a、b表示)kJ·mol-1。
(2)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
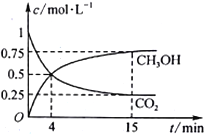
①反应进行到4 min 时,v(正)____ (填“>”“<”或“=”)v(逆)。0~4 min,CO2的平均反应速率v(CO2)=____________mol·L-1·min-1。
②CO2的平衡转化率为_______________,该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
a.v正(CH3OH)=3v逆(H2)
b.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.恒温恒压下,气体的体积不再变化
d.恒温恒容下,气体的密度不再变化
(3)在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应物投入量 | 1mol CO2,3 mol H2 | 0.5mol CO2,1.5mol H2 | 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L-1 | c1 | c1 | c3 |
平衡时体系压强/Pa | p1 | p2 | p3 |
则下列各量的大小关系为c1_________(填“>”“<”或“=”,下同)c3,p2________p3。
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:__________________________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________(填化学式)。
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 该反应进行到第3分钟时,逆反应速率大于正反应速率
B. 若要提高SO2的转化率,可用空气代替纯氧气并鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4