题目内容
【题目】一种钌(Ru)基配合物光敏染料敏化太阳能电池的工作原理及电池中发生的主要反应如图所示。下列说法错误的是
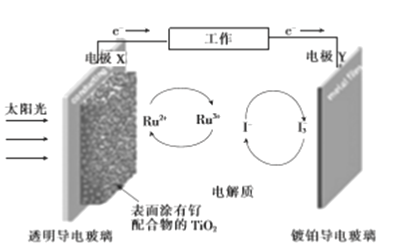
A. 电池工作时,光能转变为电能,X为电池的负极
B. 镀铂导电玻璃上发生氧化反应生成I-
C. 电解质溶液中发生反应:2Ru3++3I-![]() 2Ru2++I3-
2Ru2++I3-
D. 电池工作时,电解质溶液中I-和I3-的浓度基本不变
【答案】B
【解析】A、根据示意图,电池工作时,光能转变为电能,根据电子的流向,电极X为负极,电极Y为正极,故A说法正确;B、根据示意图,I3-→I-,化合价降低,应发生还原反应,故B说法错误;C、根据示意图,电解质溶液中发生反应:2Ru3++3I-![]() 2Ru2++I3-,故C说法正确;D、根据示意图,I-和I3-的浓度基本不变,故D说法正确。
2Ru2++I3-,故C说法正确;D、根据示意图,I-和I3-的浓度基本不变,故D说法正确。

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案【题目】温度为T1时,在三个容积均为1L的恒容密闭容器中仅发生反应: 2NO2(g)![]() 2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
2NO(g)+O2(g) (正反应吸热)。实验测得:v正=v(NO2)消耗=k正c2(NO2),v逆=v(NO)消耗= 2v(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。
下列说法正确的是
容器 编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A. 设k为该反应的化学平衡常数,则有k=k逆:k正
B. 达平衡时,容器Ⅱ与容器Ⅲ中的总压强之比为20∶17
C. 容器Ⅱ中起始平衡正向移动,达平衡时,容器Ⅱ中NO2的转化率比容器Ⅰ中的小
D. 若改变温度为T2,且T2>T1,则k正:k逆<0.8
【题目】I.由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是______________________________________。
(2)装置乙中正极的电极反应式是________________________________________。
(3)四种金属活泼性由强到弱的顺序是______________________。
II.分别按图所示甲、乙装置进行实验,图中两个烧杯中的溶液为相同浓度的稀硫酸,甲中A为电流表。

(1)下列叙述正确的是________。
A.两烧杯中铜片表面均无气泡产生 B.甲中铜片作正极,乙中铜片作负极
C.两烧杯中溶液中的H+浓度均减小 D.产生气泡的速率甲中的比乙中的慢
(2)甲装置中,某同学发现不仅铜片上有气泡产生,锌片上也产生了气体,原因可能是________________________________________________________________________。
(3)甲装置中,若把稀硫酸换成CuSO4溶液,试写出铜电极的电极反应________________________。
【题目】天然气是一种重要的化工原料,可用来生产氢气和甲醇等高附加值化学品。回答下列问题:
(1)以天然气为原料制取氢气是工业上常用的制氢方法。
已知:
①CH4(g)+H2O(g) =CO(g)+3H2(g) ΔH1=a kJ·mol-1
②CH4(g)+CO2(g) =2CO(g)+2H2(g) ΔH2=b kJ·mol-1
③CH4(g)+2H2O(g)=CO2(g)+4H2(g) ΔH3
请计算上述反应中的反应热ΔH3=_________(用a、b表示)kJ·mol-1。
(2)合成甲醇的反应原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) 在1L的密闭容器中,充入1mol CO2和3 mol H2,在500℃下发生反应,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
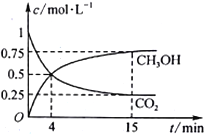
①反应进行到4 min 时,v(正)____ (填“>”“<”或“=”)v(逆)。0~4 min,CO2的平均反应速率v(CO2)=____________mol·L-1·min-1。
②CO2的平衡转化率为_______________,该温度下平衡常数为_____________。
③下列能说明该反应已达到平衡状态的是______________。
a.v正(CH3OH)=3v逆(H2)
b.CO2、H2、CH3OH和H2O浓度之比为1: 3 :1: 1
C.恒温恒压下,气体的体积不再变化
d.恒温恒容下,气体的密度不再变化
(3)在相同温度、相同容积的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 容器1 | 容器2 | 容器3 |
反应物投入量 | 1mol CO2,3 mol H2 | 0.5mol CO2,1.5mol H2 | 1mol CH3OH,1mol H2O |
CH3OH的平衡浓度/mol·L-1 | c1 | c1 | c3 |
平衡时体系压强/Pa | p1 | p2 | p3 |
则下列各量的大小关系为c1_________(填“>”“<”或“=”,下同)c3,p2________p3。
(4)为提高燃料的能量利用率,常将其设计为燃料电池。某电池以甲烷为燃料,空气为氧化剂,熔融的K2CO3为电解质,以具有催化作用和导电性能的稀土金属为电极。写出该燃料电池的负极反应式:__________________________;为使电解质的组成保持稳定,使该燃料电池长时间稳定运行,在通入的空气中必须加入________________(填化学式)。