题目内容
20.原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子;B原子核外电子有6种不同的运动状态,B与C可形成正四面体型分子,D位于第四周期,IB族.请回答下列问题:
(1)这四种元素中电负性最大的是Cl(填元素符号);
(2)C所在的主族元素气态氢化物中,沸点最低的是HCl(填化学式);
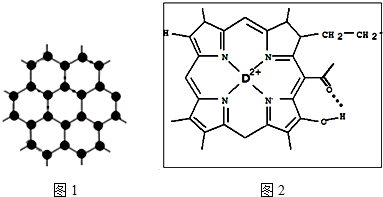
(3)B元素可形成多种单质,其中“只有一层原子厚”的物质,被公认为目前世界上已知的最薄、最坚硬、传导电子速度最快的新型材料,该材料空间结构如图1所示,其原子的杂化类型为sp2;
(4)D和钠离子与叶绿素的某种盐是一种广谱药物,具有护肝,抗氧化作用,局部结构如图2所示,该分子中含有的作用力类型是①②③④⑤(填选项序号);
①极性键 ②非极性键 ③配位键 ④氢键 ⑤离子键 ⑥金属键
(5)某学生所做的有关D元素的实验流程如下:
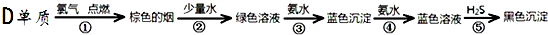
请书写第③反应的离子方程式:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+.
请书写第⑤反应的离子方程式:[Cu(NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3•H2O.
分析 原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子,则A为H元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为C元素;B与C可形成正四面体型分子,该分子为四氯化碳,则B为Cl元素;D位于第四周期,IB族,D原子外围电子排布为3d104s1,则D为Cu元素,
(1)非金属性越强,电负性越大;
(2)HF中存在氢键,沸点比HCl高,其它氢化物相对分子质量越大,沸点越高;
(3)在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键;
(4)由结构图可知,该晶体中含有C-H键、C-C键、配位键、氢键和离子键;
(5)由关系图可知,反应①铜与氯气反应生成硫化铜;氯化铜溶于水形成氯化铜溶液,氯化铜溶液中加氨水生成的蓝色沉淀为氢氧化铜,再加氨水后氢氧化铜与氨水反应生成的蓝色溶液为四氨合铜络离子,蓝色溶液通入硫化氢,生成硫化铜、铵根离子、一水合氨,据此进行解答.
解答 解:原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,其中A原子核是一个质子,则A为H元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为C元素;B与C可形成正四面体型分子,该分子为四氯化碳,则B为Cl元素;D位于第四周期,IB族,D原子外围电子排布为3d104s1,则D为Cu元素,
(1)氯元素非金属性最强,其电负性越大,
故答案为:Cl;
(2)HF中存在氢键,沸点比HCl高,其它氢化物相对分子质量越大,沸点越高,所以HCl的沸点最低,
故答案为:HCl;
(3)在其层状结构中碳碳键键角为120°,每个碳原子都结合着3个碳原子,碳原子采取sp2杂化,3个杂化轨道用来形成σ键结合其他碳原子,所有碳原子剩余2p轨道一同形成离域大π键,
故答案为:sp2;
(4)由结构图可知,该晶体中含有C-H键为极性键、C-C键为非极性键、配位键、离子键和氢键,所以①②③④⑤正确,
故选:①②③④⑤;
(5)由关系图可知,反应①铜与氯气反应生成硫化铜;反应②中氯化铜溶于水形成氯化铜溶液,反应③氯化铜溶液中加氨水生成的蓝色沉淀为氢氧化铜,反应的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;再加氨水后氢氧化铜与氨水反应生成的蓝色溶液为四氨合铜络离子,反应⑤蓝色溶液通入硫化氢,生成硫化铜、铵根离子、一水合氨,反应离子方程式为:[Cu(NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3•H2O,
故答案为:Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+;[Cu(NH3)4]2++H2S+2H2O=CuS↓+2NH4++2NH3•H2O.
点评 本题考查位置、结构与性质的关系,题目难度中等,试题综合性较大,涉及元素推断、核外电子排布规律、晶体结构与化学键、化学用语等知识,是对学生综合能力的考查,学习中注重相关基础的积累.

| A. | 已知C(石墨,s)=C(金刚石,s)△H>O,则金刚石比石墨稳定 | |
| B. | 已知2H2(g)+O2(g)═2H20(1)△H=-571.6kJ•mol-1,则氢气的燃烧热为-285.8kJ•mol-1 | |
| C. | 含20.0 gNaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则该条件下稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)═H3COOHNa(aq)+H2O(l)H=-57.4kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)=2CO2(g)△H1:2C(s)+O2(g)═2CO(g)△H2 则△H1>△H2 |
| A. | Cu是还原剂,被腐蚀 | B. | Fe2+是氧化产物 | ||
| C. | 该反应是置换反应 | D. | 该反应属于离子反应 |
| A. | 乙醇和浓硫酸加热至140℃反应:2CH3CH2OH$\stackrel{140℃}{→}$CH3CH2OCH2CH3+H2O | |
| B. | 溴乙烷与NaOH醇溶液加热反应:CH3CH2Br+NaOH$→_{△}^{醇}$CH2═CH2↑+NaBr | |
| C. | 苯酚钠溶液中通少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH↓+HCO3- | |
| D. | 乙醛溶液与银氨溶液共热:2CH3CHO+2[Ag(NH3)2]OH$\stackrel{△}{→}$2CH3COONH4+2Ag↓+3NH3+H2O |
| A. | υ(A)=0.5 mol•L-1•s-1 | B. | υ(D)=1 mol•L-1•s-1 | ||
| C. | υ(C)=1.2 mol•L-1•s-1 | D. | υ(B)=0.5 mol•L-1•s-1 |
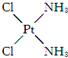 ,具有抗癌作用;反铂的结构简式为
,具有抗癌作用;反铂的结构简式为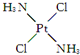 ,无抗癌作用.顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:顺式结构,顺铂易溶于水,因为它是极性分子,易溶于极性溶剂.
,无抗癌作用.顺铂和反铂的物理性质有很大差异,其中只有一种易溶于水,请你通过所学知识判断哪一种易溶于水,并说明理由:顺式结构,顺铂易溶于水,因为它是极性分子,易溶于极性溶剂.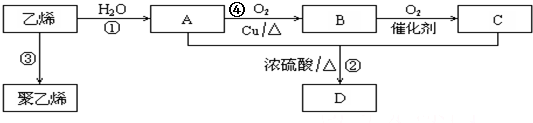
 ;
;