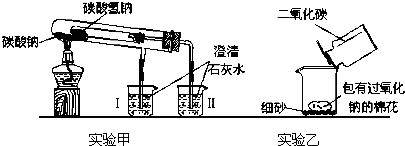
题目内容
将CO2气体通入到下列溶液中,一定有沉淀或晶体析出的是
- A.BaCl2溶液
- B.NaCl溶液
- C.Na2CO3饱和溶液
- D.Ca(OH)2溶液

 阅读快车系列答案
阅读快车系列答案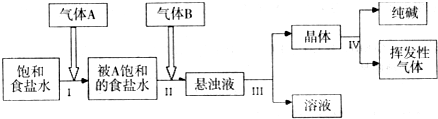
参照下表:
| 物质 | CO2 | NH3 | NaHCO3 | NH4Cl | NaCl |
| 溶解度(20℃) | V水:V二氧化碳=1:1 | V水:V氯气=1:700 | 9.6g | 37.2g | ag |
(l)气体A、B依次是
A、CO2,NH3 B、NH3,CO2 C、任何顺序都可以
(2)写出(Ⅰ)和(Ⅱ)步骤总的化学反应方程式:
(3)操作(Ⅲ)的名称是:
(4)经步骤(Ⅲ)所得液体中含有的盐为(写化学式):
(5)每当通入NH344.8L(已折合成标准状况下)时可以得到纯碱100.0g,则NH3的利用率为
| |||||||||||||||||||
将不同量的H2O和CO2气体分别通入到一恒容密闭容器中进行反应:
H2O+CO ![]() CO2+H2;得到以下三组数据,据此回答问题
CO2+H2;得到以下三组数据,据此回答问题
实验组 | 温度 | 起始量 | 平衡量 | 达到平衡 所需时间 | ||
H2O | CO | H2 | CO | |||
l | 650℃ | lmol | 2mol | 0.6mol | 1.4mol | 5min |
2 | 900℃ | 0.5mol | 1mol | 0.2mol | 0.8mol | 3min |
3 | 900℃ | a | b | c | d | t |
(1)①由以上数据,实验l中以v (CO2)表示的反应速率为_____________。
②该反应在650℃时平衡常数数值为______,该反应的逆反应为_____(填“吸”或“放”)热反应。
③若实验3要达到与实验2相同的平衡状态,且t<3min,则a,b应满足的关系为:__________。
(2)将0.2mol CO2气体通入到100mL 3mol/L的NaOH溶液中,则所得溶液中各离子浓度关系正确的是____________。
A.c(Na+)>c(HCO3-)>c(OH一)>c(CO32-)>c(H+)
B.c(HCO3-)+c(H2CO3 )+c(CO32-)=2mol/L
C.c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
D.c(Na+)+c(H+)=c(OH一)+2c(CO32-)+c(HCO3-)
(3)已知常温下H2CO3为二元弱酸,其第一、二步电离的电离常数分别为![]() 、Ka2,且
、Ka2,且![]() ≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
≈104Ka2。Na2CO3溶液的第一、二步水解反应的平衡常数称为水解常数,分别为Kh1、Kh2。
①请推导出Kh1与Ka2的关系为_________(用表达式表示);
②常温下,0.01mol/L的Na2CO3溶液的pH为_______(用含Kh1的表达式表示)。