题目内容
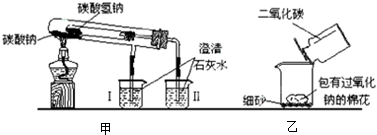
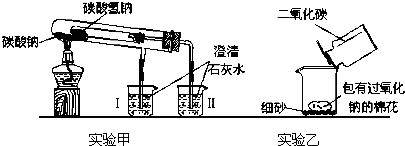
如图是两个实验装置(铁架台等辅助仪器略去未画)
回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是
(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花着火燃烧.写出Na2O2与CO2反应的化学方程式
(3)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g.求(要求写出计算过程):
①生成的CO2气体体积(标准状况下)
②原混合物中碳酸钠的质量分数.

回答下列问题:
(1)实验甲在加热过程中能观察到产生白色沉淀的烧杯是
Ⅱ
Ⅱ
(填“Ⅰ”、“Ⅱ”)烧杯,该烧杯中发生反应的离子方程式是:Ca2++2OH-+CO2=CaCO3↓+H2O
Ca2++2OH-+CO2=CaCO3↓+H2O
,通过实验甲可比较出Na2CO3、NaHCO3两种固体,Na2CO3
Na2CO3
更稳定.(2)实验乙用来验证Na2O2与CO2的反应,观察到的实验现象是:包有Na2O2的棉花着火燃烧.写出Na2O2与CO2反应的化学方程式
2Na2O2+2CO2=2Na2CO3+O2
2Na2O2+2CO2=2Na2CO3+O2
,棉花能着火燃烧说明该反应特点是该反应能放出大量的热
该反应能放出大量的热
.(3)取10.0g碳酸钠和碳酸氢钠的混合物充分进行加热,将生成的CO2气体通入足量澄清石灰水中完全吸收,测得生成沉淀4.0g.求(要求写出计算过程):
①生成的CO2气体体积(标准状况下)
②原混合物中碳酸钠的质量分数.
分析:(1)碳酸氢钠稳定性较差,烧杯Ⅱ中生成了白色沉淀,写出二氧化碳与氢氧化钙反应的离子方程式;碳酸钠比碳酸氢钠稳定;
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,该反应为放热反应;
(3)生成的沉淀为碳酸钙,计算出碳酸钙的物质的量,然后根据反应的关系式计算出生成二氧化碳的物质的量及原混合物中含有的碳酸氢钠的物质的量,再计算出标况下二氧化碳的体积和原混合物中碳酸钠的质量分数.
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,该反应为放热反应;
(3)生成的沉淀为碳酸钙,计算出碳酸钙的物质的量,然后根据反应的关系式计算出生成二氧化碳的物质的量及原混合物中含有的碳酸氢钠的物质的量,再计算出标况下二氧化碳的体积和原混合物中碳酸钠的质量分数.
解答:解:(1)碳酸钠加热不分解、碳酸氢钠受热分解产生碳酸钠、二氧化碳和水,反应的化学方程式为:Ca2++2OH-+CO2=CaCO3↓+H2O,二氧化碳使澄清石灰水变浑,证明了碳酸钠稳定性大于碳酸氢钠的,
故答案为:Ⅱ;Ca2++2OH-+CO2=CaCO3↓+H2O;Na2CO3 ;
(2)过氧化钠与二氧化碳反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,棉花能着火燃烧说明该反应是放热反应,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;该反应能放出大量的热;
(3)4g沉淀为CaCO3,n(CaCO3)=
=0.04mol,根据反应关系式:CaCO3~CO2,可知n(CO2)=n(CaCO3)=0.04mol,
①标况下生成的二氧化碳的体积为:V(CO2)=22.4L/mol×0.04mol=6.72L,
答:生成的CO2气体体积(标准状况下)为6.72L;
②根据反应关系式:2NaHCO3~CO2,n(NaHCO3)=2n(CO2)=2×0.04mol=0.08mol,
原混合物中碳酸氢钠的质量为:n(NaHCO3)=84g/mol×0.08mol=6.72g,
原混合物中碳酸钠的质量分数为:w(Na2CO3)=
×100%=32.8%,
答:原混合物中碳酸钠的质量分数为32.8%.
故答案为:Ⅱ;Ca2++2OH-+CO2=CaCO3↓+H2O;Na2CO3 ;
(2)过氧化钠与二氧化碳反应方程式为:2Na2O2+2CO2=2Na2CO3+O2,棉花能着火燃烧说明该反应是放热反应,
故答案为:2Na2O2+2CO2=2Na2CO3+O2;该反应能放出大量的热;
(3)4g沉淀为CaCO3,n(CaCO3)=
| 4g |
| 100g/mol |
①标况下生成的二氧化碳的体积为:V(CO2)=22.4L/mol×0.04mol=6.72L,
答:生成的CO2气体体积(标准状况下)为6.72L;
②根据反应关系式:2NaHCO3~CO2,n(NaHCO3)=2n(CO2)=2×0.04mol=0.08mol,
原混合物中碳酸氢钠的质量为:n(NaHCO3)=84g/mol×0.08mol=6.72g,
原混合物中碳酸钠的质量分数为:w(Na2CO3)=
| 10g-6.72g |
| 10g |
答:原混合物中碳酸钠的质量分数为32.8%.
点评:本题考查了化学实验、化学计算,题目难度中等,碳酸钠比碳酸氢钠稳定,碳酸钠加热不分解,碳酸氢钠加热分解;过氧化钠与水及二氧化碳反应均放热.

练习册系列答案
相关题目