��Ŀ����
����ͬ����H2O��CO2����ֱ�ͨ�뵽һ�����ܱ������н��з�Ӧ��
H2O+CO����![]() ���� CO2+H2���õ������������ݣ��ݴ˻ش�����
���� CO2+H2���õ������������ݣ��ݴ˻ش�����
ʵ���� | �¶� | �� ��ʼ�� | �� ƽ���� | �ﵽƽ�� ����ʱ�� | ||
H2O | CO | H2 | �� CO | |||
�� l | 650�� | �� lmol | �� 2mol | 0.6mol | 1.4mol | �� 5min |
�� 2 | 900�� | 0.5mol | �� 1mol | 0.2mol | 0.8mol | ��3min |
�� 3 | 900�� | �� a | �� b | �� c | �� d | �� t |
(1)�����������ݣ�ʵ��l����v (CO2)��ʾ�ķ�Ӧ����Ϊ_____________��
�ڸ÷�Ӧ��650��ʱƽ�ⳣ����ֵΪ______���÷�Ӧ���淴ӦΪ_____(������š�)�ȷ�Ӧ��
����ʵ��3Ҫ�ﵽ��ʵ��2��ͬ��ƽ��״̬����t<3min����a,bӦ����Ĺ�ϵΪ��__________��
(2)��0.2mol CO2����ͨ�뵽100mL 3mol��L��NaOH��Һ�У���������Һ�и�����Ũ�ȹ�ϵ��ȷ����____________��
�� A��c(Na+)>c(HCO3-)>c(OHһ)>c(CO32-)>c(H+)
�� B��c(HCO3-)+c(H2CO3 )+c(CO32-)=2mol��L
�� C��c(Na+)=2[c(H2CO3)+c(HCO3-)+c(CO32-)]
�� D��c(Na+)+c(H+)=c(OHһ)+2c(CO32-)+c(HCO3-)
(3)��֪������H2CO3Ϊ��Ԫ���ᣬ���һ����������ĵ��볣���ֱ�Ϊ![]() ��Ka2����
��Ka2����![]() ��104Ka2��Na2CO3��Һ�ĵ�һ������ˮ�ⷴӦ��ƽ�ⳣ����Ϊˮ�ⳣ�����ֱ�ΪKh1��Kh2��
��104Ka2��Na2CO3��Һ�ĵ�һ������ˮ�ⷴӦ��ƽ�ⳣ����Ϊˮ�ⳣ�����ֱ�ΪKh1��Kh2��
�����Ƶ���Kh1��Ka2�Ĺ�ϵΪ_________(�ñ���ʽ��ʾ)��
�ڳ����£�0.01mol��L��Na2CO3��Һ��pHΪ_______(�ú�Kh1�ı���ʽ��ʾ)��
(1)��0.15mol��min��
��1.8 ��
��2a=b>1mol ��a=0.5b>0.5mol����a=0.5b��a>0.5mol
(2)��B��D ��![]() ��
��![]() ��
��![]()

 ����β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ�
����β���ѳ�Ϊ��Ҫ�Ŀ�����Ⱦ���1��������ȼ������ʱ����Ӧ��N2��g��+O2��g��=2NO��g�����ǵ�������β���к���NO��ԭ��֮һ��T��ʱ����5L�ܱ������г���8mol N2��9molO2��5min���ƽ��ʱNO ���ʵ���Ϊ6mol���÷�Ӧ������v��NO��Ϊ
��2��H2��CO���Դ���ԭNO�Դﵽ������Ⱦ��Ŀ�ģ�
����֪��N2��g��+O2��g��=2NO��g����H=+180.5kJ/mol2H2��g��+O2��g��=2H2O��l����H=-571.6kJ/mol
��H2��g����NO��g����Ӧ����N2��g����H2O��l�����Ȼ�ѧ����ʽΪ
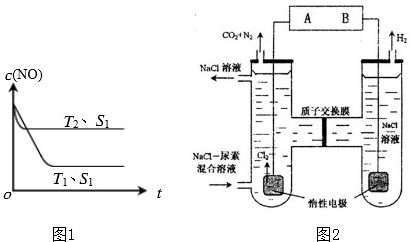
�ڵ�����һ��ʱ�������������ı���������ѧ��Ӧ���ʣ���ͼ1�Ƿ�Ӧ��
2NO��g��+2CO��g��=2CO2��g��+N2��g����NO��Ũ�����¶ȣ�T���������������S����ʱ�䣨t���ı仯���ߣ��ݴ��жϸ÷�Ӧ�ġ�H
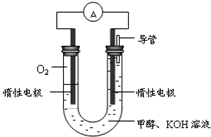
��3���˹�������ü�ӵ绯ѧ������ȥ��л�����е����أ�CO��NH2��2������ͨ��������Ӧ���ɾ���ǿ�������õ��м������������л���ԭ����ͼ2��
�ٵ�Դ�ĸ���Ϊ
���������з����ķ�ӦΪ
�۵���������������Һ��pH����ǰ��Ƚ�
��4������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�ӦCO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�
| ʵ���� | �¶ȡ� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
��ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ������ת���ʣ���
| a |
| b |
��ʵ��4����900��ʱ���ڴ������м���CO��H2O��CO2��H2��Ϊ1mol�����ʱV��
 ��2013?����һģ����1������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ�
��2013?����һģ����1������ͬ����CO��g����H2O��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������У����з�Ӧ��CO��g��+H2O��g��?CO2��g��+H2��g�����õ������������ݣ� ��2013?ͨ������ģ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ��
��2013?ͨ������ģ��̼��̼�Ļ������������������е�Ӧ�÷dz��㷺�����ᳫ���������ѳɳ����Ľ��죬����̼�������ֻ��һ�����룬����һ��ֵ���ڴ����µ����ʽ�� ��2009?���ݶ�ģ��ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�
��2009?���ݶ�ģ��ú��������úΪԭ�ϣ�������ѧ�ӹ�ʹúת��Ϊ���塢Һ�塢����ȼ���Լ����ֻ�����Ʒ�Ĺ�ҵ���̣�