题目内容
【题目】下列实验现象及相关的离子方程式均正确的是( )
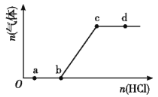
A.Cl2与FeI2溶液反应,当n(C12):n(FeI2)=1:1时,2Fe2++2I-+2C12=2Fe3++I2 +4C1-
B.向Ba(NO3)2溶液中通入SO2气体,出现白色沉淀:Ba2++SO2+H2O=BaSO3↓+2H+
C.向酸化的KMnO4溶液中滴加少量H2O2溶液,KMnO4溶液褪色:2MnO4-+7H2O2+6H+=2Mn2++6O2↑+10 H2O
D.将等物质的量浓度、等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++SO![]() +H++OH-=BaSO4↓+H2O
+H++OH-=BaSO4↓+H2O
【答案】D
【解析】
A.由于还原性I->Fe2+,因此通入Cl2后,先与I-反应,再与Fe2+反应,因此当n(C12):n(FeI2)=1:1时,没有足够的Cl2来氧化Fe2+,反应的离子方程式为:![]() ,故A项错误;
,故A项错误;
B.SO2溶于水性后形成H2SO3,具有酸性,NO3-在酸性条件下具有氧化性,能将SO2氧化成SO42-,因此反应生成BaSO4,故该反应的离子方程式为: ![]() ,故B项错误;
,故B项错误;
C.酸性KMnO4具有氧化性,能将H2O2氧化成O2,该反应的离子方程式为:![]() ,故C项错误;
,故C项错误;
D.Ba(OH)2和NaHSO4的物质的量相等,则参与反应的H+和OH-的个数比为1:1,该反应的离子方程式为:![]() ,故D项正确;
,故D项正确;
故答案为D。

 灵星计算小达人系列答案
灵星计算小达人系列答案【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。已知:CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
CO2(g)+H2(g)的平衡常数随温度的变化如下表:下列叙述正确的是
温度/℃ | 400 | 500 | 830 | 1000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
A. 该反应的正反应是吸热反应
B. 该反应达到平衡后,保持容器休积不变升高温度,正反应速率不变,容器内混合气体的压强不变
C. 830℃时,在恒容反应器中按物质的量比n(CO):n(H2O):n(H2):n(CO2)=2:4:6:1投入反应混合物发生上述反应,初始时刻v正<v逆
D. 830℃时,在2L的密闭容器中加入4molCO(g)和6molH2O(g)达到平衡时,CO的转化率是60%