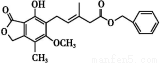
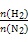题目内容
汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体相互反应转化为无毒气体。汽车尾气中CO、NO2气体在一定条件下可以发生反应:4CO(g)+2NO2(g) 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1
(1)恒温恒容条件下,不能说明该反应已达到平衡状态的是 (填字母,下同)。
A.容器内混合气体颜色不再变化
B.容器内的压强保持不变
C.2v(NO2)逆=v(N2)正
D.容器内混合气体密度保持不变
(2)能使该反应的反应速率增大,且平衡向逆反应方向移动的是 。
A.及时分离出CO2
B.适当升高温度
C.减小容器体积使体系压强增大
D.选择高效催化剂
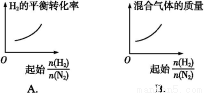
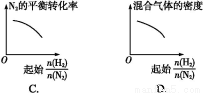
(3)对于该反应,温度不同(T2>T1)、其他条件相同时,下列图像正确的是 。
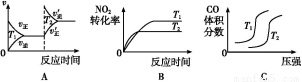
(1)CD (2)B (3)B
【解析】(1)恒温恒容下,混合气体颜色不再变化说明NO2浓度不再改变,能说明反应已达平衡;由于该反应是气体分子数减小的反应,容器内的压强保持不变,意味着气体分子总数不再改变,能说明反应已达平衡;2v逆(NO2)=v正(N2)说明反应未达平衡,反应体系中物质全为气体,气体总质量不变,在恒容条件下容器内混合气体密度一直保持不变,故密度不变,不能说明反应已达平衡。(2)分离出CO2导致反应物浓度减小,会使该反应的反应速率减小且平衡向正反应方向移动,A错;因ΔH<0,升温能使反应速率增大,平衡逆向移动,B对;该反应气体分子数减少,减小容器体积,体系压强增大导致平衡正向移动,C错;催化剂不影响化学平衡,D错。(3)升温,正、逆反应速率应同时增大,A错;升温能使反应速率增大,且由于正向反应为放热反应,升温导致平衡逆向移动,NO2转化率降低,B对;由反应特点可知,增大压强平衡右移,CO的体积分数应该减小,升高温度平衡左移,CO的体积分数应该增大,故C错。

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案依据题目要求回答下列问题。
(1)常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如表所示。
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
①上述盐溶液中的阴离子结合H+能力最强的是 。
②根据表中数据,浓度均为0.01 mol·L-1的下列五种物质的溶液中,酸性最强的是 (填字母编号,下同);将各溶液分别稀释100倍,pH变化最小的是 。
A.HCN B.HClO C.C6H5OH D.CH3COOH E.H2CO3
③根据上表数据,请你判断下列反应不能成立的是 。
A.CH3COOH+Na2CO3=NaHCO3+CH3COONa
B.CH3COOH+NaCN=CH3COONa+HCN
C.CO2+H2O+NaClO=NaHCO3+HClO
D.CO2+H2O+2C6H5Ona=Na2CO3+2C6H5OH
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸氢钠溶液,反应的离子方程式为 。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液中c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2 沉淀,则应调整溶液的pH大于 。