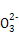题目内容
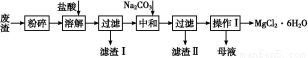
工业利用精炼镁渣(含有MgO、KCl、MgCl2、BaCl2、CaCl2、FeCl3等杂质)回收MgCl2的工业流程如下:
已知:25 ℃时有关物质的溶度积如下:
物质 | CaCO3 | MgCO3 | BaCO3 | Mg(OH)2 | Fe(OH)3 |
Ksp | 4.96×10-9 | 6.82×10-6 | 5.1×10-9 | 5.61×10-12 | 2.64×10-38 |
回答下列问题:
(1)写出溶解时的离子方程式 。
(2)溶解时温度不能太高,也不宜太低,要求控制在35 ℃左右,其理由是 。
(3)操作Ⅰ包含多个操作,分别为 ,过滤,洗涤,烘干。烘干时需要减压烘干,原因是 。
(4)为减少Na2CO3的用量和提高产品质量,在中和工序(中和后溶液接近中性)结束前要检验溶液中是否存在 离子,选择检验该离子的原因是 。
(5)母液的主要成分 。
(1)MgO+2H+=H2O+Mg2+ (2)溶解时温度太低,反应速率过慢,温度太高, HCl会挥发 (3)蒸发浓缩,冷却结晶 降低烘干时的温度,防止MgCl2·6H2O分解
(4) Ba2+ BaCO3溶解度仅小于MgCO3的溶解度,而大于其他物质的溶解度,当Ba2+除尽其他杂质已经除尽 (5)KCl 、NaCl和MgCl2
【解析】(1)MgO与盐酸反应生成H2O和MgCl2。
(2)控制温度在35 ℃左右,主要从反应速率和盐酸的挥发性方面考虑。
(3)由于MgCl2·6H2O带有结晶水,为避免其分解,不能直接蒸发结晶,要蒸发浓缩,冷却结晶,烘干时温度也不能过高。
(4)通过表中各物质的Ksp可知,BaCO3溶解度仅小于MgCO3的溶解度,而大于其他物质的溶解度,当 Ba2+除尽其他杂质已经除尽,因此要检验溶液中是否存在Ba2+。
(5)Ba2+、Fe3+和Ca2+已经在前面沉淀除去,在中和阶段引入了Na+,故母液的主要成分为KCl 、NaCl和MgCl2。

电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:

写出一个能证明还原性Fe比Cu强的离子方程式: 。
该反应在上图步骤 中发生。请根据上述反应设计一个原电池,在方框中画出简易装置图(标出电极名称、电极材料、电解质溶液)。
|
上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及主要的电极反应式 。