题目内容
元素A和B的原子序数都小于18。已知A元素原子的最外层电子数为a,次外层电子数为b;B元素原子的M电子层数为(a-b),L层电子数为(a+b),则A、B两元素所形成的化合物的性质可能有( )






A.能与水反应
B.能与氢氧化钠反应
C.能与硫酸反应
D.不能与碳酸钠反应







A.能与水反应
B.能与氢氧化钠反应
C.能与硫酸反应
D.不能与碳酸钠反应

 B
B考查原子核外电子的排布规律。B元素原子的M电子层数为(a-b),L层电子数为(a+b),所以a+b=8,且a大于b。又因为A元素原子的最外层电子数为a,次外层电子数为b,所以根据构造原理可知,A一定是第二周期元素,则b=2,所以a=6,即A是O,B是Si,形成的化合物是二氧化硅,因此选项B正确,其余都是错误的,答案选B。

练习册系列答案
相关题目
 镁,主要过程如下:
镁,主要过程如下: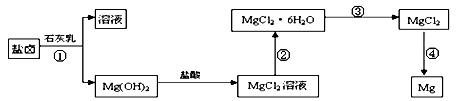
 回答下列问题:
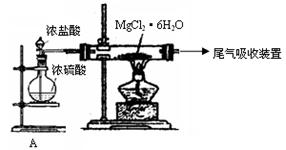
回答下列问题: 。
。
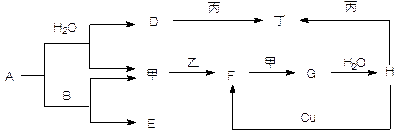
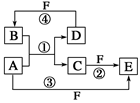
 ________________________________________。
________________________________________。 质,且反应①在水溶液中进行。
质,且反应①在水溶液中进行。