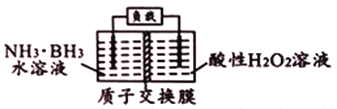
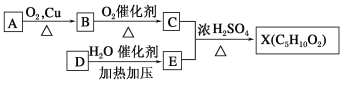
题目内容
【题目】(1)2molO3和3molO2的质量之比为________,分子数之比为________,同温同压下的密度之比为________。
(2)在标准状况下,由CO和CO2组成的混合气体6.72L,质量为12g,此混合物中CO和CO2物质的量之比是____,混合气体的平均相对分子质量是_____,对氢气的相对密度是____。
(3)19 gACl2中含有0.4 mol Cl-,则该氯化物的摩尔质量是_____;A的相对原子质量是______。
【答案】1∶12∶33∶21∶3402095 g24·mol-1
【解析】
(1)臭氧的摩尔质量为48g/mol,氧气的摩尔质量为32g/mol,根据m=nM知,其质量之比=(48g/mol×2):(32g/mol×3)=1:1,根据N=nNA知,其分子数之比等于其物质的量之比=2mol:3mol=2:3,相同条件下,气体摩尔体积相等,根据ρ=![]() 知,其密度之比等于其摩尔质量之比=48g/mol:32g/mol=3:2,故答案为:1:1;2:3;3:2;
知,其密度之比等于其摩尔质量之比=48g/mol:32g/mol=3:2,故答案为:1:1;2:3;3:2;
(2):设CO为xmol,CO2为ymol,则x+y=![]() ,28x+44y=12,解得:x=0.075,y=0.225,此混合物中CO和CO2的物质的量比是0.075:0.225=1:3,
,28x+44y=12,解得:x=0.075,y=0.225,此混合物中CO和CO2的物质的量比是0.075:0.225=1:3,![]() =
=![]() =
=![]() =40g/mol,摩尔质量与其相对分子质量在数值上相等,所以其相对分子质量为40,相同条件下气体的密度之比等于其摩尔质量之比,所以该混合气体的密度相对氢气的密度是20,故答案为:1:3;40;20;
=40g/mol,摩尔质量与其相对分子质量在数值上相等,所以其相对分子质量为40,相同条件下气体的密度之比等于其摩尔质量之比,所以该混合气体的密度相对氢气的密度是20,故答案为:1:3;40;20;
(3)因某二价金属的氯化物ACl2中含有0.4molCl-可知,氯化物ACl2的物质的量为![]() =0.2mol,则M(ACl2)=
=0.2mol,则M(ACl2)=![]() =
=![]() =95g/mol,所以ACl2相对分子质量为95,则A的相对原子质量为95-35.5×2=24.故答案为:95g/mol;24。
=95g/mol,所以ACl2相对分子质量为95,则A的相对原子质量为95-35.5×2=24.故答案为:95g/mol;24。

 名校课堂系列答案
名校课堂系列答案【题目】在 1.0 L 密闭容器中放入 0.10molA(g),在一定温度进行如下反应:A(g)![]() 2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
2B(g)+C(g)+D(s) △H= +85.1kJ·mol-1。容器内气体总压强(P)与起始压强 P0 的比值随反应时间(t)数据见下表:
时间 t/ h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 |
P /P0 | 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题:
(1)该平衡常数的表达式为_____________。
(2)下列能提高 A 的转化率的是________。
A.升高温度 B.体系中通入 A 气体 C.将 D 的浓度减小
D.通入稀有气体 He,使体系压强增大到原来的 5 倍
E.若体系中的 C 为 HCl,其它物质均难溶于水,滴入少许水
(3)前 2小时 C 的反应速率是___________ mol.L-1.h-1;
(4)平衡时 A 的转化率___________ C 的体积分数_________(均保留两位有效数字)