题目内容
6.根据下列实验及现象,能量关系正确的是( )| 实验及现象 | 能量关系 | |
| A | 将“NO2球”置于热水中,红棕色加深 | N2O4(g)?2NO2(g)△H<0 |
| B | NaOH与HCl溶液混合,溶液温度升高 | 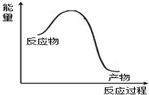 |
| C | 钠投入水中,熔化成小球 |  |
| D | 微热含酚酞的Na2CO3溶液,红色加深 | CO32-(aq)+H2O(l)?HCO3-(aq)+OH-(aq)△H<0 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
分析 A、升高温度,平衡向吸热反应方向移动;
B、酸碱中和反应为放热反应;
C、钠与水的反应为放热反应,钠的熔点较低;
D、弱酸根的水解为吸热反应.
解答 解:A、将“NO2球”置于热水中,红棕色加深,说明生成NO2的反应为吸热反应,故N2O4(g)?2NO2(g)△H>0,故A错误;
B、酸碱中和反应为放热反应,即生成物的总能量低于反应物的总能量,故B正确;
C、钠与水的反应为放热反应,即生成物的总能量低于反应物的总能量,故C错误;
D、微热含酚酞的Na2CO3溶液,红色加深,说明水解为吸热反应,即CO32-(aq)+H2O(l)?HCO3-(aq)+OH-(aq)△H>0,故D错误,
故选B.
点评 本题主要考查的是吸热反应与放热反应的判断,依据反应物与生成物的总能量关系判断即可,难度不大.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
14.能正确表示下列反应的离子方程式是( )
| A. | Cl2与水的反应:Cl2+H2O═2H++Cl-+ClO- | |
| B. | H2SO4与Ba(OH)2反应:Ba2++SO42-═BaSO4 | |
| C. | 足量铁溶于稀硝酸:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O | |
| D. | AlCl3溶液中加入过量稀氨水:Al3++3NH3•H2O═Al(OH)3 |
17.类推法是化学中常用的方法,下列类比推出的结论正确的是( )
| A. | 乙烷不能使酸性高锰酸钾褪色,故苯乙烷也不能使酸性高锰酸钾褪色 | |
| B. | 乙醛与乙酸都含有碳氧双键,故都能与H2发生加成反应 | |
| C. | 甲酸钠结构中含有醛基,能发生银镜反应,故甲酸甲酯也能发生银镜反应 | |
| D. | 甲烷与氯气在光照下反应可生成一氯甲烷,甲苯与氯气在光照下反应主要生成2,4-二氯甲苯 |
14.实验室常用反应NaNO2+NH4Cl=NaCl+N2↑+2H2O制取N2.下列有关说法正确的是( )
| A. | NaNO2是氧化剂 | B. | N2的电子式是 | ||
| C. | 生成1 mol N2时转移6 mol 电子 | D. | 氧化剂和还原剂的质量之比是1:1 |
1.下列与处理方法对应的反应方程式不正确的是( )
| A. | 工业上用水吸收NO2生产硝酸:3NO2+H2O=2HNO3+NO | |
| B. | 用氨水除去工业原料氯化铵中的氯化铁杂质:Fe3++3OH-=Fe(OH)3↓ | |
| C. | 用熟石灰处理泄漏的液氯:2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O | |
| D. | 用明矾除去水中的悬浮颗粒物:Al3++3H2O?Al(OH)3(胶体)+3H+ |
11.下列反应前后物质的总能量变化可用如图表示的是( )
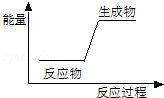

| A. | H-F═H+F | B. | Mg+2H+=Mg2++H2↑ | ||
| C. | 2Na+2H2O=2Na++2OH-+H2↑ | D. | HNO3+NaOH=NaNO3+H2O |
18.与下列装置相关的说法中不正确的是( )
| A. |  如装置中,盐桥中的K+移向CuSO4溶液 | |
| B. |  如图装置中b极析出6.4g固体时,d极产生2.24LH2 | |
| C. |  用如图装置精炼铜时,f极为粗铜 | |
| D. |  如图装置中电子沿导线由Zn流向Fe,Fe极上有大量气泡生成 |
15.下列各组物质中,最简式相同,但既不是同系物,又不是同分异构体的是( )
| A. | 丙烯、环丙烷 | B. | 乙酸、甲酸甲酯 | C. | 乙烯、1-丁烯 | D. | 甲醛、甲酸甲酯 |
16.某溶液中仅含有以下离子中的五种(不考虑水的电离和离子的水解),且各离子的物质的量浓度相等.阳离子:Na+、Mg2+、Fe2+、Al3+、Fe3+;阴离子:OH-、CO32-、Cl-、NO3-、SO42-.下列说法正确的是( )
| A. | 溶液中肯定不存在.的离子是Na+和CO32- | |
| B. | 用氢氧化钠溶液可以确定阳离子的组成 | |
| C. | 溶液中加入稀硫酸,有气体产生 | |
| D. | 溶液中存在的Cl-,可用硝酸酸化的硝酸银溶液检验 |