题目内容
【题目】(1)盐酸中加入六次甲基四胺对钢铁有一定缓蚀作用,右图为其结构简式,其分子式为(CH2)6N4,其中碳原子采用___________杂化,其缓蚀作用是因为分子中___________原子的孤对电子能与铁原子形成配位键,覆盖在钢铁表面。

(2)CO与N2属于等电子体,1个CO分子中含有的π键数目是___________个。
C、N、O三种元素的笫一电离能最大的是___________。
(3)右图是某化合物的晶胞示意图,硅原子与铝原子之间都以共价键连接。

①该化合物的化学式是___________。
②Si元素基态原子的电子排布式是___________。
③已知晶胞边长为5.93×10-8cm,Si与A1之间的共价键键长是___________cm(只要求列算式,不必计算出数值,下同),晶体的密度是___________g·cm-3
【答案】 sp3杂化 氮 2 N LiAlSi 1s22s22p63s23p2 ![]() ×5.93×10-8/4
×5.93×10-8/4 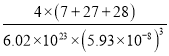
【解析】(1)根据结构简式可知分子中碳原子全部形成单键,碳原子采用sp3杂化杂化。氮原子含有孤对电子,所以其缓蚀作用是因为分子中氮原子的孤对电子能与铁原子形成配位键,覆盖在钢铁表面。(2)CO与N2属于等电子体,结构相似,则1个CO分子中含有的π键数目是2个。非金属性越强,第一电离能越大,但氮元素的2p轨道电子处于半充满状态,稳定性强,则
C、N、O三种元素的笫一电离能最大的是N。(3)①根据晶胞结构可知Si原子个数是4,Al原子个数是8×1/8+6×1/2=4,Li原子个数是12×1/4+1=4,因此该化合物的化学式是LiAlSi。②Si元素的核外电子数是14,基态原子的电子排布式是1s22s22p63s23p2。③已知晶胞边长为5.93×10-8cm,则其体对角线是![]() 。Si与A1之间的共价键键长是对角线的1/4,即为
。Si与A1之间的共价键键长是对角线的1/4,即为![]() 。晶体的密度是
。晶体的密度是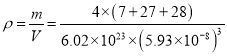 g·cm-3。
g·cm-3。