题目内容
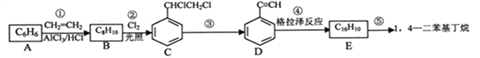
【题目】1,4-二苯基丁烷是用来研究聚合物溶剂体系热力学性质的重要物质,工业上用下列方法制备1, 4-二苯基丁烷。(格拉泽反应:2R-C≡C-H![]() R-C≡C-C≡C-R+H2)
R-C≡C-C≡C-R+H2)

回答下列问题:
(1)②和⑤的反应类型分别为__________________、____________。
(2)反应③由C生成D的条件是_____________________。
(3)E的结构简式为___________,该分子中位于同一直线上的原子最多是___________个。
(4)反应①的化学方程式是___________。
(5)C与足量氢氧化钠水溶液反应可制得化合物F,F的分子式是__________,同时符合下列条件的F的同分异构体有_____________种(不含立体异构)。
①1mol该异构体最多能与2mol NaOH溶液反应
②该异构体的核磁共振氢谱显示为3组峰,且峰面枳之比为1:1:3
【答案】 取代反应 加成反应 NaOH的醇溶液并加热 ![]() 10
10 ![]() C8H10O2 4
C8H10O2 4
【解析】1,4-二苯基丁烷是用来研究聚合物溶剂体系热力学性质的重要物质,工业上用下列方法制备1, 4-二苯基丁烷。(格拉泽反应:2R-C≡C-H![]() R-C≡C-C≡C-R+H2)
R-C≡C-C≡C-R+H2)
回答下列问题:
由B的分子式、C的结构简式可知B为![]() ,则A与乙烯发生加成反应生成B,则A为
,则A与乙烯发生加成反应生成B,则A为![]() .对比C、D的结构可知C脱去2分子HCl,同时形成碳碳三键得到D,该反应属于消去反应.D发生信息中的格拉泽反应生成E为
.对比C、D的结构可知C脱去2分子HCl,同时形成碳碳三键得到D,该反应属于消去反应.D发生信息中的格拉泽反应生成E为![]() ,E与氢气加成生成1,4-二苯基丁烷。
,E与氢气加成生成1,4-二苯基丁烷。
(1)根据上述分析,反应②为取代反应,反应⑤为加成反应,故答案为:取代反应;加成反应;
(2)反应③是卤代烃的消去反应,由C生成D的条件是NaOH的醇溶液并加热,故答案为:NaOH的醇溶液并加热;
(3)根据上述分析, E为![]() ,苯环是正六边形结构,碳碳三键是直线形结构,该分子中位于同一直线上的原子最多有10个,故答案为:
,苯环是正六边形结构,碳碳三键是直线形结构,该分子中位于同一直线上的原子最多有10个,故答案为:![]() ;10;
;10;
(4)反应①的化学方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)C与足量氢氧化钠水溶液反应可制得化合物F,F的分子式为C8H10O2,①1mol该异构体最多能与2mol NaOH溶液反应,说明结构中含有2个酚羟基或者是甲酸苯酚酯;②该异构体的核磁共振氢谱显示为3组峰,且峰面枳之比为1:1:3,同时符合条件的F的同分异构体有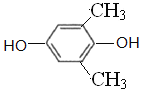 、
、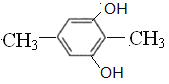 、
、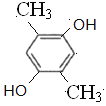 、
、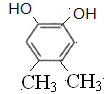 共4种,故答案为:C8H10O2;4。
共4种,故答案为:C8H10O2;4。

【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:

已知:还原焙烧主反应为:2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)在实验室进行步骤A,需要用到的仪器为________________,步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为_________。
(2)步骤C中得到的滤渣主要成分是_______________,步骤D中还原剂与氧化剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为________,其目的是_____________________________。
(4)步骤G的离子方程式为___________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=__________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:
Mn2++S2O82-+H2O=H++SO42-+MnO4-,
①请配平上述离子方程式____________________________;
②确认Mn2+离子已经完全反应的现象是_______________________________。
【题目】乙醛酸(OHC-COOH)是合成名贵香料的原料之一。
I.由乙二醛催化氧化制乙醛酸的反应如下:2OHC-CHO(g)+O2(g) ![]() 2OHC-COOH(g)△H
2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表1:
化学键 | O=O | C-O | O-H | C-H |
键能(KJ/mol) | 498 | 351 | 465 | 413 |
计算上述反应的△H=____________kJ·mol-1。
(2)一定条件下,按照![]() 投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。
投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。

①该反应在A点放出的热量________B点放出的热量(填“>”、“=”或“<”)
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由__________。
③图中A点时,乙醛酸的体积分数为_____________。
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有__________ (列举一条)。
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图所示。
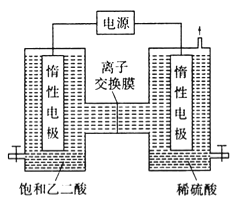
(1)图中的离子交换膜为___________ (填“阳”或“阴”)膜。
(2)稀硫酸的作用为____________。
(3)生成乙醛酸的电极反应式为_______________。