题目内容
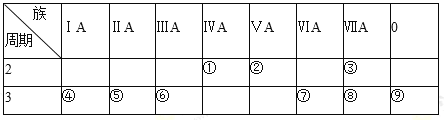
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,且A、B、C均含有Z元素。A的焰色反应呈黄色,水溶液呈弱碱性;B是两性氢氧化物;D是由W与Q形成的化合物,0.1mol·L-1D溶液的pH为1。在一定条件下它们之间的相互转化关系如图所示。下列说法正确的是( )

A. X、Y、Z元素的离子半径大小是X>Y>Z
B. X元素的氢化物沸点比同主族元素的氢化物低
C. Y与Q和W与Q元素形成的化合物化学键类型相同
D. Q的最高价氧化物对应的水化物和氢化物的酸性在同主族元素中是最强的
【答案】A
【解析】短周期元素W、X、Y、Z、Q的原子序数依次增大,已知A、B、C、D是它们两种或三种元素间形成的化合物,0.1molL-1D溶液的pH为1,D为HCl,D是由W与Q形成的化合物,W为H,Q为Cl;B是两性氢氧化物,则B为Al(OH)3,且A、B、C均含有Z元素,A的焰色反应呈黄色,水溶液呈弱碱性,A为NaAlO2;结合转化可知C为AlCl3,再结合原子序数可知,X为O,Y为Na,Z为Al,则A.具有相同电子排布的离子中,原子序数大的离子半径小,则X、Y、Z元素的离子半径大小是X>Y>Z,A正确;B.水分子间含氢键,则X元素的氢化物沸点比同主族元素的氢化物高,B错误;C.Y与Q形成NaCl中含离子键,W与Q元素形成HCl含共价键,C错误;D.Q的最高价氧化物对应的水化物为高氯酸,酸性最强,而氢化物的酸性小于HBr、HI酸,D错误;答案选A。

【题目】碳酸锰(MnCO3)是制造电信器材的软磁铁氧体,也用作脱硫的催化剂,瓷釉、涂料和清漆的颜料。工业上利用软锰矿(主要成分是MnO2,还含有Fe2O3、CaCO3、CuO等杂质)制取碳酸锰的流程如下图所示:

已知:还原焙烧主反应为:2MnO2+C![]() 2MnO+CO2↑。
2MnO+CO2↑。
可能用到的数据如下:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Mn(OH)2 |
开始沉淀pH | 1.5 | 6.5 | 4.2 | 8.3 |
沉淀完全pH | 3.7 | 9.7 | 7.4 | 9.8 |
根据要求回答下列问题:
(1)在实验室进行步骤A,需要用到的仪器为________________,步骤B中若采用质量分数为35%的硫酸(密度ρ=1.26 g/cm3),则其物质的量浓度为_________。
(2)步骤C中得到的滤渣主要成分是_______________,步骤D中还原剂与氧化剂的物质的量之比为__________。
(3)步骤E中调节pH的范围为________,其目的是_____________________________。
(4)步骤G的离子方程式为___________________,若Mn2+沉淀完全时测得溶液中CO32-的浓度为2.2×10-6 mol/L,则Ksp(MnCO3)=__________。
(5)实验室可以用Na2S2O8溶液来检验Mn2+是否完全发生反应,原理为:
Mn2++S2O82-+H2O=H++SO42-+MnO4-,
①请配平上述离子方程式____________________________;
②确认Mn2+离子已经完全反应的现象是_______________________________。
【题目】乙醛酸(OHC-COOH)是合成名贵香料的原料之一。
I.由乙二醛催化氧化制乙醛酸的反应如下:2OHC-CHO(g)+O2(g) ![]() 2OHC-COOH(g)△H
2OHC-COOH(g)△H
(1)已知反应中相关的化学键键能数据如表1:
化学键 | O=O | C-O | O-H | C-H |
键能(KJ/mol) | 498 | 351 | 465 | 413 |
计算上述反应的△H=____________kJ·mol-1。
(2)一定条件下,按照![]() 投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。
投料比进行上述反应,乙二醛的平衡转化率(a)和催化剂催化效率随温度变化如图所示。

①该反应在A点放出的热量________B点放出的热量(填“>”、“=”或“<”)
②某同学据图推知,生成乙醛酸的速率:v(A)>v(B),你认为此结论是否正确,简述理由__________。
③图中A点时,乙醛酸的体积分数为_____________。
④为提高乙二醛的平衡转化率,除改变投料比、温度外,还可以采取的措施有__________ (列举一条)。
Ⅱ.利用惰性电极电解饱和乙二酸和稀硫酸溶液也可以制备乙醛酸,原理如图所示。
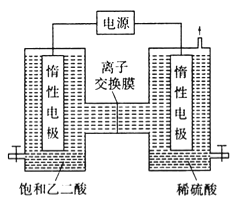
(1)图中的离子交换膜为___________ (填“阳”或“阴”)膜。
(2)稀硫酸的作用为____________。
(3)生成乙醛酸的电极反应式为_______________。
【题目】在给定条件下,下列离子组的离子共存判断及反应的离子方程式均正确的是
选项 | 条件 | 离子组 | 离子共存判断及的离子方程式 |
A |
| Fe2+、NO3-、Al3+、Cl- | 不能大量共存, 3Fe2++4H++NO3-=3Fe3++NO+2H2O |
B | 由水电离出c(H+) =1×10-13mol·L-1 | K+、NH4+、Cl-、AlO2- | 能大量共存 |
C | 含有大量Al3+的溶液 | Na+、NH4+、SO42-、Cl- | 能大量共存 |
D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存, 2ClO-+SO2+H2O=2HClO+SO32- |
A. A B. B C. C D. D