题目内容
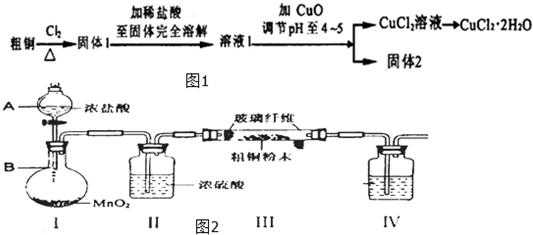
18. 一学习小组利用如图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
一学习小组利用如图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.(1)向A中加入10g废铜屑样品,关闭弹簧夹,打开B活塞向A注入足量稀硫酸后关闭.①此时装置C中产生的现象是水面下降,水顺长导管排入D中.
②反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体,则该废铜屑中铜的质量百分含量为88.8%.
(2)接下来使Cu完全溶解的操作是:
①拆除C、D装置后,打开弹簧夹
②持续将空气通入A中,至A中固体全部消失
(3)为使A中固体加快溶解速率,以下方法运用合理的是abde.
a.对A装置加热
b.向A内加入少量Fe2O3
c.向A内加入少量CuO
d.增大空气通入量
e.向A内加入少量FeSO4
f.向A内加入少量H2O
(4)将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁元素被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液.
①此过程的离子反应方程式是Cu2(OH)2CO3+H++Fe3+=2Cu2++Fe(OH)3↓+CO2↑.
②检验溶液中铁元素是否被完全沉淀最好的方法是c
a.取样于试管→滴加KSCN溶液;
b.取样于试管→滴加酸性KMnO4溶液
c.取样于试管→纸上层析后→喷KSCN溶液;
(5)有同学认为,可以不用测量气体法计算废铜屑中铜的质量百分含量,其具体操作步骤可续写为:将(4)中所得红褐色沉淀洗涤、干燥、称量、计算.
分析 (1)①A中的废铜屑含有铁加入稀硫酸反应生成氢气,装置C是排水量气装置;
②10g废铜屑样品,反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体为氢气物质的量为0.02mol,Fe+H2SO4=FeSO4+H2↑,铁物质的量为0.02mol,质量为0.02mol×56g/mol=1.12g,计算得到铜的质量计算铜的质量分数;
(2)拆除C、D装置后,打开弹簧夹,持续将空气通入A中,生成的亚铁离子被空气中 的氧气氧化为铁离子,铁离子和铜反应生成亚铁离子,至A中固体全部消失;
(3)加快A中的固体溶解速率增大,可以依据影响反应速率的因素分析;
(4)①将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,依据反应现象和反应物和产物分析书写离子方程式;
②溶液中的铁元素主要是铁离子,用KSCN溶液可以检验铁离子,为了不影响实验结果,不能直接滴加KSCN溶液;
(5)依据题干信息不用测定气体体积,可以依据沉淀法测定沉淀质量计算铁元素质量来计算得到铜的质量分数.
解答 解:(1)①A中的废铜屑含有铁加入稀硫酸反应生成氢气,装置C是排水量气装置,现象是C中液面下降,水被排到D中,
故答案为:水面下降,水顺长导管排入D中;
②10g废铜屑样品,反应进行到A中不再产生气泡时,若C中收集到448mL(已换算成标准状况)气体为氢气物质的量为0.02mol,Fe+H2SO4=FeSO4+H2↑,铁物质的量为0.02mol,质量为0.02mol×56g/mol=1.12g,该废铜屑中铜的质量百分含量=$\frac{10g-1.12g}{10g}$×100%=88.8%,
故答案为:88.8%;
(2)拆除C、D装置后,打开弹簧夹,持续将空气通入A中,生成的亚铁离子被空气中 的氧气氧化为铁离子,铁离子和铜反应生成亚铁离子,至A中固体全部消失,
故答案为:持续将空气通入A中,至A中固体全部消失;
(3)为使A中固体加快溶解速率,
a.对A装置加热,会加快反应速率,故a正确;
b.向A内加入少量Fe2O3,溶解后自动铁离子浓度会提高溶解铜的反应速率,故b正确;
c.向A内加入少量CuO,和硫酸反应不能加快溶解速率,故c错误;
d.增大空气通入量,自动氧气浓度可以提高反应速率,故d正确;
e.向A内加入少量FeSO4,增大了亚铁离子浓度能加快反应速率,故e正确;
f.向A内加入少量H2O,稀释溶液浓度,反应速率减小,故f错误;
故选abde;
(4)①将A中溶液倒入烧杯内,加入Cu2(OH)2CO3将其调节至pH=4时,溶液中铁被完全沉淀,过滤后即得红褐色沉淀与硫酸铜溶液,此过程离子反应方程式是
Cu2(OH)2CO3+H++Fe3+=2Cu2++Fe(OH)3↓+CO2↑,
故答案为:Cu2(OH)2CO3+H++Fe3+=2Cu2++Fe(OH)3↓+CO2↑;
②溶液中的铁元素主要是铁离子,用KSCN溶液可以检验铁离子,为了不影响实验结果,不能直接滴加KSCN溶液,所以可以用纸上层析后,喷KSCN溶液的方法,
故选c;
(5)不用测量气体法,可以依据沉淀方法,测定沉淀氢氧化铁质量,计算铁元素质量,得到铜的质量,计算废铜屑中铜的质量百分含量,沉淀实验方法为:得到的氢氧化铁沉淀洗涤、干燥、称量、计算,
故答案为:将(4)中所得红褐色沉淀洗涤、干燥、称量、计算.
点评 本题考查了物质性质的探究实验方法和实验设计,掌握物质性质和实验反应原理是解题关键,题目难度中等.

| A. | Fe分别与氯气和稀盐酸反应所得氯化物相同 | |
| B. | Al、Fe、Cu三者的单质放置在空气中均只生成氧化物 | |
| C. | Al、Fe、Cu三者对应的氧化物均为碱性氧化物 | |
| D. | C、P、S、Cl的最高价氧化物对应水化物的酸性逐渐增强 |
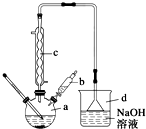 溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:
溴苯是一种常用的化工原料.实验室制备溴苯的实验步骤如下:步骤1:在a中加入15mL苯和少量铁屑,再将b中4.0mL液溴慢慢加入到a中,充分反应.
步骤2:向a中加入10mL水,然后过滤除去未反应的铁屑.
步骤3:滤液依次用10mL水、8mL 10%的NaOH溶液、10mL 水洗涤,分液得粗溴苯.
步骤4:向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤即得粗产品.
| 苯 | 溴 | 溴苯 | |
| 密度/g•cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 在水中的溶解度 | 微溶 | 微溶 | 微溶 |
(2)将b中的液溴慢慢加入到a中,而不能快速加入的原因是防止反应放出的热使C6H6、Br2挥发而影响产率.
(3)仪器c的作用是冷凝回流,回流的主要物质有C6H6、Br2 (填化学式).
(4)步骤4得到的粗产品中还含有杂质苯.已知苯、溴苯的有关物理性质如上表,则要进一步提纯粗产品,还必须进行的实验操作名称是蒸馏.
| A. | X的值为1 | |
| B. | M的平均反应速率为0.15 mol•L-1•min-1 | |
| C. | M的转化率为60% | |
| D. | 平衡时P的浓度为0.25 mol•L-1 |
| A. | 含有 NA个氦原子的氦气在标准状况下的体积约为11.2L | |
| B. | 25℃,1.01×105Pa,44g CO2中含有的分子数为NA | |
| C. | 在常温常压下,22.4L Cl2含有的分子数为1.0NA | |
| D. | 在标准状况下,22.4L H2O含有的分子数为1.0NA |
| A. | 向NH4Al(S04)2溶液中滴加过量Ba(OH)2溶液:2Ba2++40H-+2S042-+Al3+=2BaS04↓+2H20+Al02- | |
| B. | 向NaHS04溶液中滴Ba(OH)2溶液至S042-完全沉淀:2 H++S042-+Ba2++20H-=BaS04↓+2H20 | |
| C. | 向0.1mol.L-l、pH=l的NaHA溶液中加入NaOH溶液:HA-十OH-=A2-+H20 | |
| D. | 向1L lmol.L-1的FeBr2溶液中通等物质的量Cl2:2Cl2+2Fe2++2Br-=4Cl-十2Fe3++Br2 |