题目内容
向某FeBr2溶液中,通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计。则下列说法中正确的是
| A.原溶液的浓度为0.1mol/L | B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) | D.原溶液中c(Br-)=0.4mol/L |
B
解析试题分析:通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L,表明氯气全部参与了氧化还原反应。若FeBr2溶液中的溴离子也参与氧化还原反应的话,则二价铁离子的浓度就小于0.1mol/L ,那么原溶液中的溴离子的浓度最大不超过0.2mol/L,这与题意不符。因此,该题中只能判断为二价铁离子参与氧化还原反应。则原溶液的浓度为c(FeBr2)="0.15mol/L" A、错误;B、正确;C、反应后溶液中c(Fe3+)=2c(Fe2+),错误;D、原溶液中c(Br-)=0.3mol/L,正确。
考点:考查氧化还原反应跟离子反应的的基本知识。

 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案下列各组物质相互作用时,其中水既不作氧化剂,又不作还原剂,而反应仍属于氧化还原反应的是
| A.氟与水反应 | B.Na与水反应 | C.铝与强碱液作用 | D.过氧化钠与水反应 |
在5NH4NO3 2HNO3+9H2O+4N2↑反应中,被还原的氮原子与被氧化的氮原子数目比为
2HNO3+9H2O+4N2↑反应中,被还原的氮原子与被氧化的氮原子数目比为
| A.3∶5 | B.5∶3 | C.5∶2 | D.2∶1 |
Cl2、HCl的混合气体通入足量的氢氧化钠溶液,充分反应后分析产物溶液中除大量OH?外,还有Cl?、ClO?、ClO3?,并知这三种离子的物质的量比为9:2:1。试问原混合气体中Cl2与HCl体积比为
| A.2:5 | B.3:1 | C.5:2 | D.1:1 |
向含有Fe2+、I-、Br-的溶液中通入适量氯气,溶液中各种离子的物质的量变化如下图所示。有关说法不正确的是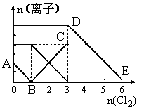
| A.线段BC代表Fe3+物质的量的变化情况 |
| B.原混合溶液中c(FeBr2)=6mol/L |
| C.当通入Cl22mol时,溶液中已发生的离子反应可表示为: 2Fe2++2I-+2C12=2Fe3++I2+4Cl- |
| D.原溶液中n(Fe2+):n(I-):n(Br-)=2:1:3 |
苹果汁中含有Fe2+,它是人们喜欢的一种补铁饮料,现榨的苹果汁在空气中会由淡绿色逐渐变为棕黄色。若榨汁时加入维生素C,可以防止这种现象发生。这说明维生素C有
| A.还原性 | B.氧化性 | C.碱性 | D.酸性 |
下列说法正确的是
| A.非金属元素(稀有气体元素除外)都是主族元素,单质在反应中都只能作氧化剂 |
| B.常温下,1 mol氯气和足量稀NaOH溶液完全反应转移1mol电子 |
| C.在加热条件下,用乙醇除去乙酸乙酯中的乙酸 |
| D.硫酸铜溶液显酸性的原因:Cu2+ + 2H2O = Cu(OH)2↓+ 2H+ |
下列说法正确的是
| A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 |
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为:N2(g) + 3H2(g)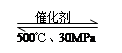 2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1 |
C.对于可逆反应N2(g)+3H2(g)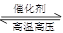 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动 |
| D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
制造太阳能电池需要高纯度的硅,工业上制高纯硅常用以下反应:
①Si(s)+3HCl(g) 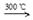 SiHCl3(g)+H2(g) +381 kJ
SiHCl3(g)+H2(g) +381 kJ
②SiHCl3(g)+H2(g) 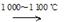 Si(s)+3HCl(g)
Si(s)+3HCl(g)
对上述两个反应的叙述中,错误的是
| A.两个反应都是置换反应 | B.反应②是吸热反应 |
| C.两个反应互为可逆反应 | D.两个反应都是氧化还原反应 |