题目内容
下列说法正确的是
| A.含4molHCl的浓盐酸与足量MnO2充分反应,转移2NA个电子 |
B.500℃、30MPa下,将0.2mol N2和0.6molH2置于密闭的容器中充分反应生成NH3(g),放热7.72kJ,其热化学方程式为:N2(g) + 3H2(g)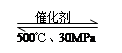 2NH3(g)△H=-38.6kJ·mol-1 2NH3(g)△H=-38.6kJ·mol-1 |
C.对于可逆反应N2(g)+3H2(g)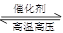 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动 2NH3(g)△H﹤0,升高温度,可使反应速率增大,反应逆向移动 |
| D.元素原子的最外层电子数的多少与其非金属性的强弱无必然联系 |
C
解析试题分析:A、反应开始后浓盐酸逐渐变为稀盐酸,后者不能被MnO2氧化,则消耗的n(HCl)<4mol,故转移电子数小于2NA,错误;B、可逆反应不能进行到底,则消耗的n(N2)<0.2mol,故热化学方程式的△H<-38.6kJ·mol-1,错误;C、合成氨是放热反应,升高温度时,v(正)、v(逆)均增大,平衡向逆反应方向移动,正确;D、元素原子的最外层电子数的多少与其非金属性的强弱有关,同周期主族元素从左到右,非金属性随最外层电子数增多而增强,错误。
考点:考查氧化还原反应中转移电子数、热化学方程式的书写、反应热的计算、温度对反应速率和化学平衡的影响、原子结构与元素的性质之间关系等相关知识。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案多硫化钠Na2Sx(x>2)在结构上与Na2O2、FeS2、CaC2等有相似之处。Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,反应中Na2Sx与NaClO的物质的量之比为1︰13,则x的值是
| A.5 | B.4 | C.3 | D.2 |
向某FeBr2溶液中,通入1.12L(标准状况)的Cl2,测得溶液中c(Br-)=3c(Cl-)=0.3mol/L。反应过程中溶液的体积变化不计。则下列说法中正确的是
| A.原溶液的浓度为0.1mol/L | B.反应后溶液中c(Fe3+)=0.1mol/L |
| C.反应后溶液中c(Fe3+)=c(Fe2+) | D.原溶液中c(Br-)=0.4mol/L |
我国的新(饮用天然矿泉水国家标准)规定了饮用水中可能致癌物溴酸盐的限值:0.01mg/L,日前很多饮用水企业都采用臭氧消毒法进行水的消毒,这个过程可能生成溴酸盐。原因是水中的Br-被臭氧氧化为BrO2-,其过程示意为:Br-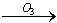 BrO-
BrO-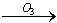 BrO2-
BrO2-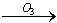 BrO3-,下列有关说法正确的是
BrO3-,下列有关说法正确的是
| A.臭氧消毒法和明矾净水原理相同,都是利用胶体吸附原理 |
| B.若改用氧气消毒,可避免生成溴酸盐 |
| C.BrO- 3氧化性比O3强 |
| D.生成溴酸盐的过程是给水消毒的副反应,需控制条件减少BrO3-的产生 |
物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与HCl溶液,由于溶液浓度不同而能发生不同氧化还原反应的是( )
| A.①③ | B.③④ | C.①② | D.①④ |
工业上可用硫酸铝与硫磺焙烧制备氧化铝:2A12(SO4)2+3S 2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
| A.反应中Al2(SO4)3被氧化 |
| B.Al2(SO4)3、A12O3均含有离子键和共价键 |
| C.5.1 g A12O3含有9.03×1022个阴离子 |
| D.该反应中,每转移0.3 mol电子生成5.04 L SO2 |
下列工业生产的主要反应原理不涉及氧化还原反应的是
| A.硝酸工业 | B.接触法制硫酸 | C.合成氨工业 | D.氨碱法制纯碱 |
下列物质的用途,应用了氧化还原反应的是
| A.用食醋除去热水瓶胆壁上的水垢 | B.用次氯酸钠溶液消毒浴池 |
| C.盐卤用于制豆腐 | D.用小苏打发酵面团制作馒头 |