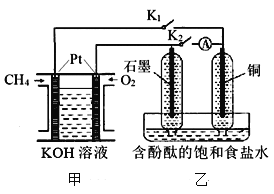
题目内容
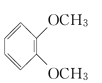
【题目】分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是( )
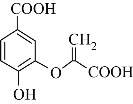
A. 可看成羧酸类、酯类等B. 分枝酸分子中含有3种官能团
C. 分子式为C10H10O 6D. 1mol分枝酸最多可与3molNaOH发生反应
【答案】D
【解析】
由结构简式可知,分枝酸的分子式为C10H10O6,分子中含有的官能团为羧基、酚羟基、碳碳双键、醚键,能表现羧酸、酚、烯烃的性质。
A项、分枝酸分子中不含有酯基,不可看成酯类,故A错误;
B项、分枝酸分子中含有的官能团为羧基、酚羟基、碳碳双键、醚键4种官能团,故B错误;
C项、根据结构简式确定分枝酸分子的分子式为C10H10O6,故C错误;
D项、分枝酸分子中含有两个羧基和一个酚羟基,羧基和酚羟基均能与氢氧化钠反应,则1mol分枝酸最多可与3molNaOH发生反应,故D正确。
故选D。

练习册系列答案
相关题目