题目内容
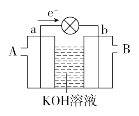
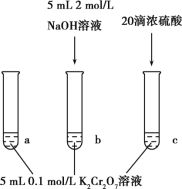
【题目】某同学研究K2Cr2O7溶液中的化学平衡,设计如图所示实验。已知:Cr2O72-+H2O![]() 2CrO42-+2H+△H=+13.8kJ/mol。实验现象如下:
2CrO42-+2H+△H=+13.8kJ/mol。实验现象如下:
i.试管a中溶液为橙色;
ii.试管b中溶液为黄色;
iii.试管c中滴加浓硫酸后温度略有升高,溶液变为深橙色。
下列说法正确的是
A.该反应是一个氧化还原反应
B.b试管中不存在Cr2O72-
C.该实验不能证明减小生成物浓度平衡正向移动
D.试管c中影响平衡的主要因素是温度
【答案】C
【解析】
A.反应前后元素的化合价不变,该反应是一个非氧化还原反应,故A错误;
B.Cr2O72-+H2O![]() 2CrO42-+2H+,是可逆反应,转化率不可能达到100%,b试管中存在Cr2O72-,故B错误;
2CrO42-+2H+,是可逆反应,转化率不可能达到100%,b试管中存在Cr2O72-,故B错误;
C.滴加浓硫酸,放出热量,温度、浓度均影响平衡移动,则该实验不能证明减小生成物浓度,平衡正向移动,可能升高温度平衡正向移动,故C正确;
D.试管c中温度、氢离子浓度均变化,则c中的现象不能说明影响平衡的主要因素是温度,故D错误;
故选C。

练习册系列答案
相关题目
【题目】一定温度下,在2 L的恒容密闭容器中发生反应![]() 。反应过程中的部分数据如下表所示:
。反应过程中的部分数据如下表所示:
n/mol t/min |
|
|
|
0 | 2.0 | 2.4 | 0 |
5 | 0.9 | ||
10 | 1.6 | ||
15 | 1.6 |
下列说法正确的是( )
A.0~5 min用A表示的平均反应速率为![]()
B.该反应在10 min后才达到平衡
C.平衡状态时,![]()
D.物质B的平衡转化率为20%