题目内容
20.已知有反应BrO${\;}_{3}^{-}$+5Br-+6H+═3Br2+3H2O.下列反应中从反应原理来看与该反应最相似的是( )| A. | 2KNO3═2KNO2+O2↑ | B. | NH4HCO3═NH3↑+CO2↑+H2O | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | SO2+2H2S═3S↓+2H2O |
分析 反应BrO${\;}_{3}^{-}$+5Br-+6H+═3Br2+3H2O,化合价变化都发生在Br元素之间,属于归中的氧化还原反应,据此分析.
解答 解:A、2KNO3═2KNO2+O2↑属于分解的氧化还原反应反应,并且化合价发生在N和O两种元素之间,故A不符合;
B、NH4HCO3═NH3↑+CO2↑+H2O,没有化合价变化,不属于氧化还原反应,故B不符合;
C、3NO2+H2O═2HNO3+NO化合价只发生在N元素之间,但属于歧化反应,故C不符合;
D、SO2+2H2S═3S↓+2H2O化合价只发生在S元素之间,并且属于归中反应,故D符合;
故选D.
点评 本题考查氧化还原反应的判断,关键分析BrO${\;}_{3}^{-}$+5Br-+6H+═3Br2+3H2O,化合价变化都发生在Br元素之间,属于归中的氧化还原反应,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.设NA代表阿伏加德罗常数的数值,下列说法中正确的是( )
| A. | 常温常压下,32g氧气所含的原子数为NA | |
| B. | 标准状况下,22.4L 四氯化碳的分子数为NA | |
| C. | 0℃,101KPa下,44.8L氮气所含有的分子数为2NA | |
| D. | 常温常压下,1mol氦气含有的分子数为2NA |
11.由乙醛和乙酸乙酯组成的混合物中,若含碳的质量分数为A%,则此混合物中含氢的质量分数为( )
| A. | (100-$\frac{7A}{6}$)% | B. | 10A% | C. | ($\frac{A}{6}$)% | D. | 6A% |
8.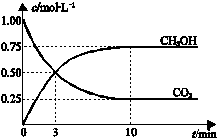 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
 已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )
已知:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1.一定条件下,向体积为1L的密闭容器中充入1mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如图所示.下列叙述中,正确的是( )| A. | 升高温度能使$\frac{n(C{H}_{3}OH)}{n(C{O}_{2})}$增大 | |
| B. | 反应达到平衡状态时,CO2的平衡转化率为75% | |
| C. | 3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率 | |
| D. | 从反应开始到平衡,H2的平均反应速率υ(H2)=0.075mol/(L.min) |
12.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 在常温常压下,11.2 L Cl2含有的分子数为0.5NA | |
| B. | 在常温常压下,1 mol氢气含有的分子数为NA | |
| C. | 在常温常压下,32 g氧气含原子数为NA | |
| D. | 标准状况下,1mol水的体积约为22.4L |
9.下列说法不正确的是( )
| A. | 1mol固态物质或液态物质的体积主要决定于构成这种物质的粒子的大小 | |
| B. | 在相同温度和压强下,任何气体粒子之间的距离可看成相等的 | |
| C. | 某同学用容量瓶配制溶液加水时不慎超出刻度线必须重新配制 | |
| D. | 为与容量瓶的精度相匹配称量固体质量时应用托盘天平 |
10.用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 10g 46%的乙醇溶液所含氢原子数为1.2NA | |
| B. | 0.5 mol熔融的NaHSO4中含有的离子数目为1.5NA | |
| C. | 标准状况下,2.24L甲醇中含有C-H键的数目为0.3NA | |
| D. | S2和S8的混合物共38.4g,其中所含硫原子数为1.4NA |
 .
. .
.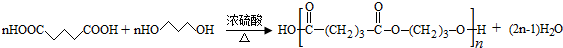 .
. (写构简式)
(写构简式)