题目内容
【题目】形形色色的物质,构成了我们这个五彩缤纷的世界。世上万物,神奇莫测,常常超乎人们按“常理”的想象。学习物质结构和性质的知识,能使你想象的翅膀变得更加有力。
(1)基态Ga原子的电子排布式是[Ar] __。氮化镓是一种新型材料,可把手机信号放大10倍,氮化镓的功效与电子跃迁有关,而元素的光谱也与电子的跃迁有关。下列变化过程不会产生原子光谱的是__(填字母序号)。
A.[Ar]3d44s2→[Ar]3d54s1
B.![]()
C.![]()
D.![]()
(2)锂离子电池是现代高性能电池的代表,LiFePO4因具有良好的结构稳定性而成为新一代正极材料,这与PO43-的结构密切相关,PO43-的立体构型为___,P、O、S的第一电离能从大到小的顺序为___。
(3)在硫酸铜溶液中加入过量KCN,可生成配位化合物离子[Cu(CN)4]2-,则1mol[Cu(CN)4]2-中含有的σ键的数目为___;写出一种与CN-互为等电子体的单质的分子式___。
(4)钙和钴都是第四周期元素,且原子的最外层电子数相同,钴的熔沸点远高于钙,其原因是___。
(5)Na2S的晶胞结构如图所示。已知Na+的半径为0.102nm,S2-的半径为0.184nm,则Na2S的晶胞参数a=___cm(列出计算式即可)。
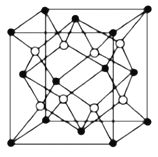
【答案】3d104s24p1 C 正四面体形 O>P>S 8NA N2 钙和钴都属于金属晶体,Ca的原子半径较大且价电子数较少,金属键较弱 ![]() ×10-8
×10-8
【解析】
(1)Ga是31号元素,其基态原子的核外电子排布式为[Ar]3d104s24p1;
A.[Ar]3d44s2→[Ar]3d54s1过程中,前者能量高于后者,发生电子的跃迁,能够产生原子光谱,A不选;
B.![]() 过程中,前者能量低于后者,发生电子的跃迁,能够产生原子光谱,B不选;
过程中,前者能量低于后者,发生电子的跃迁,能够产生原子光谱,B不选;
C.![]() 过程中,前后都为基态原子,没有能量变化,不能够产生原子光谱,C选;
过程中,前后都为基态原子,没有能量变化,不能够产生原子光谱,C选;
D.![]() 过程中,前者能量低于后者,发生电子的跃迁,能够产生原子光谱,D不选;
过程中,前者能量低于后者,发生电子的跃迁,能够产生原子光谱,D不选;
故答案为:3d104s24p1;C;
(2)PO43-中心P原子的价层电子对数为![]() ,不含有孤对电子,则其立体构型为正四面体形;同周期从左到右元素的第一电离能呈增大趋势,同主族从上到下元素的第一电离能逐渐减小,又P原子的3p轨道为3p3半充满结构,其第一电离能比S大,因此第一电离能由大到小的顺序为O>P>S,故答案为:正四面体形;O>P>S;
,不含有孤对电子,则其立体构型为正四面体形;同周期从左到右元素的第一电离能呈增大趋势,同主族从上到下元素的第一电离能逐渐减小,又P原子的3p轨道为3p3半充满结构,其第一电离能比S大,因此第一电离能由大到小的顺序为O>P>S,故答案为:正四面体形;O>P>S;
(3)[Cu(CN)4]2-中Cu2+和CN-形成4个配位键,配位键属于σ键,CN-中C和N形成1个σ键,则1mol[Cu(CN)4]2-中含有的σ键的数目为8NA,原子总数和价电子总数分别都相等的互为等电子体,与CN-互为等电子体的单质可以是N2,故答案为:8NA;N2;
(4)Ca和Co均为金属晶体,Ca的原子半径大于Co,且价电子数比Co少,则Ca的金属键较弱,熔点比Co低,故答案为:钙和钴都属于金属晶体,Ca的原子半径较大且价电子数较少,金属键较弱;
(5)Na2S的晶胞结构中,晶胞参数为a,则体对角线为![]() a,体对角线上黑球与白球间的距离为体对角线长度的
a,体对角线上黑球与白球间的距离为体对角线长度的![]() ,从而得出
,从而得出![]() ×
×![]() a=(0.102+0.184)nm,
a=(0.102+0.184)nm,![]() ,故答案为:
,故答案为:![]() ×10-8。
×10-8。