��Ŀ����
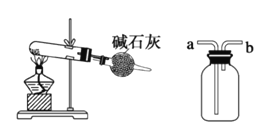
����Ŀ����1�����õ绯ѧԭ����CO��SO2ת��Ϊ��Ҫ����ԭ�ϣ�װ����ͼ��ʾ��
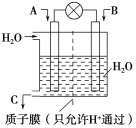
����AΪCO��BΪH2��CΪCH3OH����ͨ��CO��һ��Ϊ___�����ü��ĵ缫��ӦʽΪ___��
����AΪSO2��BΪO2��CΪH2SO4�����ĵ缫��ӦʽΪ___��
����AΪNH3��BΪO2��CΪHNO3���������ĵ缫��ӦʽΪ___��
����������������ص��200mL����0.1mol��L��1NaCl��0.1mol��L��1CuSO4�Ļ����Һ(�缫��Ϊ���Ե缫)�������ı����0.448LH2ʱ����������������Ϊ___(�ѧʽ)�������ʵ���Ϊ___����Һ��pH��___(����ͭ����ˮ�⣬������ǰ����Һ�������)��
��2������2CrO42-��2H��![]() Cr2O72-��H2O���ͼʾװ��(��Ϊ���Ե缫)
Cr2O72-��H2O���ͼʾװ��(��Ϊ���Ե缫)
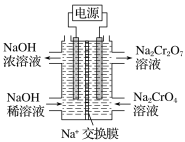
���Na2CrO4��Һ��ȡNa2Cr2O7��ͼ���Ҳ�缫���ӵ�Դ��___������缫��ӦʽΪ___��
���𰸡��� CO+4e-+4H+=CH3OH SO2+2H2O-2e-= SO42-+4H+ O2+4e-+4H+=2H2O Cl2��O2 0.01mol��0.005mol 1 �� 4 OH--4e- = O2��+2H2O
��������
�����������õ绯ѧԭ����CO��SO2ת��Ϊ��Ҫ����ԭ�Ͽ�֪�����⿼��绯ѧ֪ʶ������ԭ���ԭ���͵���ԭ��������
��1����ȼ�ϵ���У�ͨ���������ĵ缫��������ͨ�뻹ԭ���ĵ缫�Ǹ������÷�Ӧ��CԪ�ػ��ϼ���+2�۱�Ϊ-2�ۡ�HԪ�ػ��ϼ���0�۱�Ϊ+1�ۣ�����CO������������ͨ��CO�ĵ缫Ϊ�������缫����ʽΪCO+4e-+4H+=CH3OH��
�ʴ�Ϊ������CO+4e-+4H+=CH3OH��
����AΪSO2��BΪO2��CΪH2SO4�������϶�������ʧ���Ӻ�ˮ��Ӧ������������Ӻ������ӣ��缫��ӦʽΪSO2+2H2O-2e-= SO42-+4H+��
�ʴ�Ϊ��SO2+2H2O-2e-= SO42-+4H+��
����AΪNH3��BΪO2��CΪHNO3��������������ԭ��Ӧ�������õ�������ˮ���缫����ʽΪO2+4e-+4H+=2H2O��
�ʴ�Ϊ��O2+4e-+4H+=2H2O��
�ܼ���õ�����⺬��0.02mol CuSO4��0.02molNaCl�Ļ����Һ200mL�������ı����0.448LH2ʱ��![]() �����·��ת����0.04mole-�����ݵ缫��Ӧ�͵����غ�����жϣ�������2Cl- - 2e- = Cl2�� ��
�����·��ת����0.04mole-�����ݵ缫��Ӧ�͵����غ�����жϣ�������2Cl- - 2e- = Cl2�� ��
0.02mol 0.02mol 0.01mol
4OH- - 4e- = 2H2O + O2��
0.02mol 0.02mol 0.005mol
������Cu2+ + 2e- = Cu
0.02mol 0.04mol
�������������Ӽ���0.02mol������Һ������������0.02mol����Һ��������Ũ��=![]() ����ҺpH=1��
����ҺpH=1��
�ʴ�Ϊ��Cl2��O2�� 0.01mol��0.005mol��1��
��2������2CrO42-+2H+ ![]() Cr2O72-+H2O���ͼʾװ�ã���Ϊ���Ե缫�����NaCrO4��Һ��ȡNaCr2O7����Ҫͨ���������OH-�������Һ�����ԣ�˵���ڸõ缫�����������ӵ�Դ���������缫��ӦʽΪ4OH--4e-=O2��+2H2O��
Cr2O72-+H2O���ͼʾװ�ã���Ϊ���Ե缫�����NaCrO4��Һ��ȡNaCr2O7����Ҫͨ���������OH-�������Һ�����ԣ�˵���ڸõ缫�����������ӵ�Դ���������缫��ӦʽΪ4OH--4e-=O2��+2H2O��
�ʴ�Ϊ������4OH--4e- = O2��+2H2O��

 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д� ���������ν�ϵ�д�
���������ν�ϵ�д�����Ŀ����Դ������������������Դ���õ��ǵ����������Ż��⡣�������ѧ��ѧ֪ʶ�ش��������⣺
(1)�����ϰ�װ��ת��������ʹ����β���е���Ҫ��Ⱦ��(CO��NOx��̼�⻯����)�������Ӧ�����������ʣ���������β����Ⱦ��
��֪��N2(g) + O2(g)��2NO(g) ��H��+180.5 kJ��mol��1��
2C(s)+ O2(g)��2CO(g) ��H����221.0 kJ��mol��1��
C(s)+ O2(g)��CO2(g) ��H����393.5 kJ��mol��1��
��β��ת����Ӧ2NO(g) +2CO(g)��N2(g)+2CO2(g)�ġ�H��________________��
(2)ij���᳧���ü״�������ˮ����һ�������£����ˮ�м���CH3OH����HNO3��ԭ��N2�����÷�Ӧ����32 g CH3OHת��6 mol���ӣ���μӷ�Ӧ�Ļ�ԭ���������������ʵ���֮��Ϊ______________��
(3)ú�ļ��Һ������ת��ΪCO��H2�����ڴ��������ºϳɼ״�������һ���¶��£���1 L�ܱ������м���CO��H2��������ӦCO(g)+2H2(g)CH3OH(g)����10 min��Ӧ�ﵽƽ��ʱ��ø���ֵ�Ũ�����£�
���� | CO | H2 | CH3OH |
Ũ��/(mol��L��1) | 1.2 | 1.0 | 0.6 |
�ٸ÷�Ӧ��ƽ�ⳣ������ʽΪ��K��_____________________��
�ڸ�ʱ���ڷ�Ӧ������(H2)��_________________��
��ƽ��ʱCO��ת����Ϊ_________________(����1λС��)