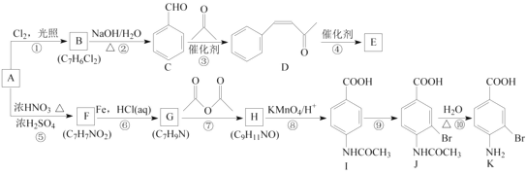
题目内容
【题目】已知:H2(g)+![]() O2(g)
O2(g)![]() H2O(g),反应过程中能量变化如图所示,请回答下列问题。
H2O(g),反应过程中能量变化如图所示,请回答下列问题。
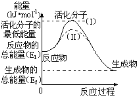
(1)对于同一反应,图中虚线(Ⅱ)与实线(I)相比,活化能_____,单位体积内活化分子的百分数__,因此反应速率____,(前面的三个空填“增大”“减小”“不变”)你认为最可能的原因是_______。
(2)在一固定容积的密闭容器中,进行如下反应:CsH2Og![]() COgH2g。若容积体积为2L,反应10s H2质量增加0.4g,则该时间内CO的反应速率为___。若增加炭的量,则正反应速率____(选填“增大”、“减小”、“不变”)。若增大压强,化学平衡向_____移动(选填“正向”、“逆向”或“不”)。
COgH2g。若容积体积为2L,反应10s H2质量增加0.4g,则该时间内CO的反应速率为___。若增加炭的量,则正反应速率____(选填“增大”、“减小”、“不变”)。若增大压强,化学平衡向_____移动(选填“正向”、“逆向”或“不”)。
(3)若降低温度,平衡逆向移动,则正反应是______反应(选填“吸热”或“放热”)。
【答案】减小 增大 增大 使用催化剂 0.01 mol/(L·s) 不变 逆向 吸热
【解析】
(1)图象分析虚线是降低反应的活化能,化学平衡不变化,单位体积内活化分子数增多反应速率加快,改变的条件是加入了催化剂;
(2)根据题意找出氢气的物质的量浓度变化量,结合![]() 及速率之比等于化学计量数之比计算;C为纯固体,增加用量,速率不变;该反应为气体体积增大的反应,增大压强向体积缩小的方向移动。
及速率之比等于化学计量数之比计算;C为纯固体,增加用量,速率不变;该反应为气体体积增大的反应,增大压强向体积缩小的方向移动。
(3)依据升温对平衡的影响效果分析作答。
(1)图象分析可知,虚线表示的是降低反应的活化能,单位体积内活化分子数增多反应速率加快,但达到平衡状态相同,化学平衡不变化,改变的条件是加入了催化剂;故答案为:减小;增大;增大;使用催化剂;
(2)若容器体积为2L,反应10 s氢气质量增加0.4g,可知△c(H2)=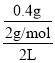 =0.1mol/L,v(H2)=
=0.1mol/L,v(H2)=![]() =0.01mol/(L.s),由速率之比等于化学计量数之比可知,该时间内一氧化碳的反应速率为0.01mol/(L.s);若增加炭的量,则正反应速率不变;该反应为气体体积增大的反应,若增大压强,化学平衡向逆向移动,
=0.01mol/(L.s),由速率之比等于化学计量数之比可知,该时间内一氧化碳的反应速率为0.01mol/(L.s);若增加炭的量,则正反应速率不变;该反应为气体体积增大的反应,若增大压强,化学平衡向逆向移动,
故答案为:0.01;不变;逆向;
(3)若降低温度,平衡逆向移动,则正反应是吸热反应,故答案为:吸热。

 阅读快车系列答案
阅读快车系列答案