题目内容
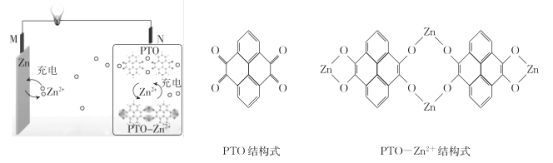
【题目】利用如图所示的电化学装置处理工业尾气中的硫化氢可实现硫元素的回收。下列说法中正确的是
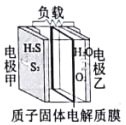
A. 电池工作时电子由电势高的电极甲经负载向电势低的电极乙移动
B. 电池工作一段时间后,理论上消耗O2和H2S的体积相等
C. 当有1molH2S参与反应,则有2molH+由负极区进入正极区
D. 电极甲上的电极反应为:2H2S+4OH――4e-=S2+4H2O
【答案】C
【解析】
A.电池工作时,甲为负极,电子经外电路从甲流向乙,电子从低电势向高电势移动,故A错误;
B.该电池总反应为2H2S + O2==S2 +2 H2O,消耗O2和H2S的体积比为1:2,故B错误;
C.负极反应为2H2S – 4e—== S2 + 4 H+,为维持电解质中电荷守恒,1molH2S参与反应生成的2mol H+需要通过质子固体电解质膜进入正板区,故C正确;
D.负极反应为2H2S – 4e—== S2 + 4 H+,故D错误。
本题选C。

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目