题目内容
【题目】决定物质性质的重要因素是物质结构。请回答下列问题:
(1)基态K原子中,核外电子占据最高能层的符号是_______,占据该能层电子的电子云轮廓图形状为______________。
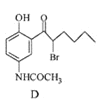
(2)已知元素M是组成物质![]() 的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号
的一种元素。元素M的气态原子逐个失去第1个至第5个电子所需能量(即电离能,用符号![]() 至
至![]() 表示)如表所示:
表示)如表所示:
|
|
|
|
| |
电离能 | 589.8 | 1145.4 | 4912.4 | 6491 | 8153 |
元素M化合态常见化合价是_________价,其基态原子电子排布式为_______
(3)![]() 的中心原子的杂化方式为__________,键角为____________
的中心原子的杂化方式为__________,键角为____________
(4)![]() 中非金属元素电负性由大到小的顺序为_____________
中非金属元素电负性由大到小的顺序为_____________
(5)下列元素或化合物的性质变化顺序正确的是_______________
A.第一电离能:![]() B.共价键的极性:
B.共价键的极性:![]()
C.晶格能:![]() D.热稳定性:
D.热稳定性:![]()
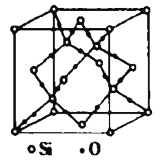
(6)如图是![]() 晶胞,构成二氧化硅晶体结构的最小环是由________个原子构成。已知晶胞参数为
晶胞,构成二氧化硅晶体结构的最小环是由________个原子构成。已知晶胞参数为![]() ,则其晶胞密度为________
,则其晶胞密度为________![]() 。
。
【答案】N 球形 +2 1s22s22p63s23p64s2或[Ar] 4s2 sp3 109°28′ F>O>P BC 12 ![]()
【解析】
(1)基态K原子共有4给电子层,最高能层位N;价层电子排布式为4s1;
(2) M的第三电离能远远大于第二电离能,该元素最外层有2个电子;
(3)根据价层电子互斥理论确定![]() 杂化方式及空间构型;
杂化方式及空间构型;
(4)Ca3(PO4)3F中非金属元素为P、O、F,同周期主族元素自左而右电负性增大,同主族自上而下电负性减小;
(5) A. 同周期元素的第一电离能有增大的趋势,价层电子处于充满或半充满状态时,第一电离能大于其后元素的;
B.键合原子的电子亲合能或电负性的差值越大,极性越大;
C. 离子半径越小,键长越短,晶格能越大;
D. 金属阳离子的半径越小,其碳酸盐的热稳定性越弱;
(6)构成二氧化硅晶体结构的最小环是六元环,根据密度公式![]() 计算晶体密度。
计算晶体密度。
(1)基态K原子共有4给电子层,最高能层位N;价层电子排布式为4s1,该能层电子云轮廓为球形,故答案为:N;球形;
(2) M的第三电离能远远大于第二电离能,说明该元素失去2个电子时为稳定结构,则该元素最外层有2个电子,则M为Ca,元素M化合态常见化合价是+2,其基态原子电子排布式为:1s22s22p63s23p64s2或[Ar] 4s2,故答案为:+2;1s22s22p63s23p64s2或[Ar] 4s2;
(3)![]() 的中心原子P的孤电子对数为:1/2(a-xb)=1/2(5+3-2×4)=0,价层电子对数为:4+0=4,P原子杂化方式为sp3杂化,空间构型为正四面体,键角为109°28′,故答案为:sp3;109°28′;
的中心原子P的孤电子对数为:1/2(a-xb)=1/2(5+3-2×4)=0,价层电子对数为:4+0=4,P原子杂化方式为sp3杂化,空间构型为正四面体,键角为109°28′,故答案为:sp3;109°28′;
(4)Ca3(PO4)3F中非金属元素为P、O、F,同周期主族元素自左而右电负性增大,同主族自上而下电负性减小,所以电负性:F>O>P,故答案为:F>O>P;
(5) A. 同周期元素的第一电离能有增大的趋势,价层电子处于全充满或半充满状态时,第一电离能大于其后元素的第一电离能,则Cl>P>S>Si,A错误;
B.键合原子的电子亲合能或电负性的差值越大,极性越大,则共价键的极性:HF>HCl>HBr>HI,B正确;
C. 离子半径越小,键长越短,晶格能越大,则晶格能:NaF>NaCl>NaBr>NaI,C正确;
D. 金属阳离子的半径越小,其碳酸盐的热稳定性越弱,则热稳定性:BaCO3>SrCO3>CaCO3>MgCO3,D错误;故答案为:BC。
(6)构成二氧化硅晶体结构的最小环是六元环,其中有6个Si原子和6个O原子,所以构成二氧化硅晶体结构的最小环是由12个原子构成;1个晶胞中含有Si原子的数目为:8×1/8+6×1/2+4=8,含有O原子的数目为:16,则根据公式:![]() ,其晶胞的密度为:
,其晶胞的密度为:
![]() ,故答案为:12;
,故答案为:12;![]() 。
。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案